





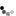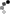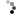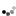 Рейтинг: 4.5/5.0 (1808 проголосовавших)
Рейтинг: 4.5/5.0 (1808 проголосовавших)Категория: Инструкции
BIOGEN IDEC, Ltd. (Великобритания)
АТХ: L04AA23 (Natalizumab)
Иммунодепрессивный препарат, применяемый при рассеянном склерозеПрепарат Тизабри содержит натализумаб - селективный ингибитор молекул адгезии. Тизабри связывается с ?4-субъединицей человеческого интегрина, в большом количестве экспрессирующегося на поверхности всех лейкоцитов, за исключением нейтрофилов. Натализумаб специфически связывается с ?4?1-интегрином, блокируя при этом взаимодействие с соответствующим рецептором, адгезивной молекулой клеток сосудов (VCAM-1) и лигандом остеопонтина, доменом фибронектина, образовавшимся в результате альтернативного сплайсинга, соединительным сегментом-1 (CS-1). Кроме этого, натализумаб блокирует взаимодействие ?4?7-интегрина с молекулой адгезии слизистой оболочки, адрессином-1 (MadCAM-1). Влияние на эти молекулярные взаимодействия препятствует миграции мононуклеарных лейкоцитов через эндотелий в очаги воспаления паренхиматозных органов. Дальнейший механизм действия натализумаба может быть обусловлен подавлением воспалительных реакций в пораженных тканях путем подавления взаимодействия ?4-экспрессирующих лейкоцитов с их лигандами во внеклеточном веществе и на клетках паренхимы. Таким образом натализумаб может подавлять воспалительную активность в пораженных тканях и дальнейшее привлечение иммунных клеток к очагу воспаления.
Повреждение тканей головного мозга при рассеянном склерозе (PC) происходит при переходе активированных Т-лимфоцитов через гематоэнцефалический барьер (ГЭБ). Миграция лейкоцитов через ГЭБ включает взаимодействие между молекулами адгезии на поверхности активированных лейкоцитов и эндотелием кровеносных сосудов. Взаимодействие между ?4?1 и его мишенями является важным компонентом патогенеза формирования очагов воспаления в головном мозге, поэтому нарушение этих взаимодействий снижает активность воспаления. При нормальных условиях VCAM-1 не экспрессируется в паренхиме головного мозга. Однако в присутствии провоспалительных цитокинов выработка VCAM-1 в клетках эндотелия и, возможно, в глиальных клетках, находящихся вблизи очага воспаления, регулируется по механизму положительной обратной связи. В условиях воспаления ЦНС при PC взаимодействие ?4?1 с VCAM-1, CS-1 и остеопонтином опосредует прочную адгезию и миграцию лейкоцитов в головном мозге и может усиливать воспалительный каскад в тканях ЦНС. Блокада молекулярных взаимодействий ?4?1 с его мишенями снижает воспалительную активность в паренхиме головного мозга при PC и подавляет дальнейшее привлечение иммунных клеток в очаги воспаления, тем самым снижая образование или замедляя увеличение объема поражения при PC.
Данные доклинического изучения безопасности
Многократно проведенные доклинические исследования по безопасности не показали каких-либо особых факторов риска для человека и генотоксичности.
В большинстве исследований in vivo было обнаружено изменение миграции лимфоцитов, что согласуется с фармакологической активностью натализумаба; отмечено повышение количества лейкоцитов и массы селезенки. Эти изменения были обратимы и не имели каких-либо видимых токсикологических последствий.
В исследованиях на мышах при введении натализумаба не отмечено ускорения деления клеток меланомы и лимфобластного лейкоза.
При исследовании методом Эймса или анализе на хромосомные аберрации, мутагенного эффекта при применении натализумаба у человека не выявлено. При исследовании пролиферации клеточных линий опухолей, содержащих ?4-интегрин, in vitro, не выявлено признаков цитотоксичности.
В исследовании на морских свинках с применением доз, превышающих рекомендованные для человека, не было выявлено влияния натализумаба на репродуктивную способность самцов.
Для оценки влияния натализумаба на репродуктивную функцию было проведено 5 исследований, 3 из них на морских свинках и 2 на обезьянах Cynomolgus. Эти исследования не показали тератогенных эффектов или влияния на рост потомства. В одном исследовании на морских свинках было отмечено незначительное снижение выживаемости детенышей. В исследовании на обезьянах в группе, получившей 30 мг/кг натализумаба частота самопроизвольных абортов увеличилась вдвое по сравнению с контрольной группой. Это явилось результатом высокой частоты самопроизвольных абортов в первой группе, что не наблюдалось во второй группе. В другом исследовании не было выявлено влияния на частоту самопроизвольных абортов. Исследование на беременных самках обезьян Cynomolgus показало влияние натализумаба на плод, включавшее полную анемию, снижение концентрации тромбоцитов, увеличение массы селезенки и снижение массы печени и тимуса. Эти изменения были связаны с повышением экстрамедуллярного кроветворения в селезенке, атрофией тимуса и снижением кроветворения в печени. Снижение концентрации тромбоцитов отмечено также у потомства самок, получавших натализумаб до родов, однако, признаков анемии у них не отмечено. Все изменения наблюдались при дозах, превышающих рекомендованную для человека и приходили в норму после прекращения приема натализумаба.
У некоторых самок обезьян Cynomolgus, получавших натализумаб до родов, отмечена незначительная концентрация натализумаба в молоке, что указывает на возможность выделения натализумаба с грудным молоком у женщин.
Средняя максимальная сывороточная концентрация натализумаба после повторного внутривенного введения в дозе 300 мг больным PC была 110 ± 52 мкг/мл. Средняя стационарная концентрация натализумаба в период введения варьировала от 23 до 29 мкг/мл. Про.
Противопоказания— гиперчувствительность к натализумабу или любому из вспомогательных веществ;
— прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ);
— повышенный риск инфекции условно-патогенными микроорганизмами, в т.ч. иммунодефицитные состояния (напри. посмотреть полностью
Терапия Тизабри должна назначаться и находиться под постоянным контролем врачей, специализирующихся на диагностике и лечении неврологических заболеваний, в учреждениях, имеющих возможности проведения МРТ.
Пациентам, получающим Тизабри, необходи. посмотреть полностью
О случаях передозировки не сообщалось.
Лекарственное взаимодействиеБезопасность и эффективность Тизабри в сочетании с другими иммунодепрессантами или противоопухолевыми препаратами пока недостаточно установлена. Сопутствующий прием этих препаратов может повысить риск инфекции, в том числе условно-патогенными микр. посмотреть полностью
Побочное действиеВо время плацебоконтролируемого исследования на 1617 больных PC, получавших натализумаб в течение 2 лет (плацебо 1135), нежелательные явления, приведшие к досрочному прекращению участия, наблюдались у 5,8% больных, получавших натализумаб (и 4,8% п. посмотреть полностью
При беременности и кормлении грудьюДанных о введении натализумаба беременным женщинам недостаточно. Исследования на животных показали репродуктивную токсичность. Возможный риск для людей неизвестен. Не следует назначать натализумаб во время беременности без крайней необходимости. Е. посмотреть полностью
Применение при нарушении функции печениИсследований по оценке эффектов препарата при нарушенной функции печени не проводилось.
Механизм выведения и результаты изучения фармакокинетики позволяют предположить, что препарат можно назначать больным с нарушенной функцией печени без измен. посмотреть полностью
Исследований по оценке эффектов препарата при нарушенной функции почек не проводилось.
Механизм выведения и результаты изучения фармакокинетики позволяют предположить, что препарат можно назначать больным с нарушенной функцией почек без изменен. посмотреть полностью
Тизабри противопоказан детям и подросткам.
Применение у пожилых пациентовПрименение Тизабри у пациентов старше 65 лет не рекомендуется из-за отсутствия данных о безопасности для этой категории больных
Особые указанияПрогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ)
Применение Тизабри может повысить риск развития ПМЛ и, как результат, привести к смертельному исходу или тяжелой инвалидизации.
Риск возникновения ПМЛ увеличивался по мере продолжительно. посмотреть полностью
противопоказан при беременности, противопоказан при кормлении грудью, возможно применение при нарушениях функции печени, возможно применение при нарушениях функции почек, противопоказан для детей, c осторожностью применяется пожилыми пациентами
ФармакокинетикаСредняя максимальная сывороточная концентрация натализумаба после повторного внутривенного введения в дозе 300 мг больным PC была 110 ± 52 мкг/мл. Средняя стационарная концентрация натализумаба в период введения варьировала от 23 до 29 мкг/мл. Про. посмотреть полностью
Условия отпуска из аптек Условия храненияХранить концентрат и готовый к применению раствор при температуре 2-8°С, в защищенном от света месте. Не замораживать. Хранить в недоступном для детей месте.
Срок годности: концентрат - 4 года, готовый к применению раствор - 8 часов. Не использ. посмотреть полностью
Концентрат для приготовления раствора для инфузий в виде бесцветного, прозрачного или слегка опалесцирующего раствора.
1 мл
натализумаб
20 мг
Вспомогательные вещества: натрия дигидрофосфата моногидрат, натрия гидрофосфата гептагидрат. посмотреть полностью
Не нашли нужно информации?
Еще более полную инструкцию к препарату «тизабри (tysabri)» можно найти здесь:
pro-tabletki.info /тизабри (tysabri)
Если у вас есть опыт назначения этого препарата своим пациентам -- поделитесь результатом (оставьте комментарий)! Помогло ли это лекарство пациенту, возникли ли побочные эффекты во время лечения? Ваш опыт будет интересен как вашим коллегам, так и пациентам.
Если вам было назначено это лекарство и вы прошли курс терапии, расскажите -- было ли оно эффективным (помогло ли), были ли побочные эффекты, что вам понравилось/не понравилось. Тысячи людей ищут в Интернет отзывы к различным лекарствам. Но только единицы их оставляют. Если лично вы не оставите отзыв на эту тему -- прочитать остальным будет нечего.
Провизор Онлайн15 мл - флаконы стеклянные (1) - пачки картонные.
Для монотерапии ремиттирующей формы рассеянного склероза следующим группам больных:
— пациентам с активным течением заболевания, несмотря на лечение интерфероном бета. Данная группа пациентов, может быть определена как группа пациентов не поддающихся лечению полным и адекватным курсом (по крайней мере в течение одного года) интерферона бета. У них должно быть не менее одного рецидива в течение предыдущего года терапии и не менее 9 Т2-гиперинтенсивных очагов на магнитно-резонансной томографии головного мозга (МРТ) или не менее одного очага, видимого при применении контрастных средств для МРТ, содержащих гадолиний. Под пациентами "без ответа" на проводимую терапию следует понимать пациентов с неизменной или увеличенной частотой обострений по сравнению с предыдущим годом, либо текущими тяжелыми обострениями даже при лечении продолжительностью менее года;
— пациентам с быстро прогрессирующим тяжелым ремиттирующим рассеянным склерозом (т.е. перенесшим 2 или большее число обострений в течение года и имеющим 1 и более очагов на МРТ головного мозга, накапливающих контрастные средства для МРТ, содержащих гадолиний, либо значительное увеличение объема поражения в режиме Т2 по сравнению с результатами предыдущей МРТ).
— гиперчувствительность к натализумабу или любому из вспомогательных веществ;
— прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ);
— повышенный риск инфекции условно-патогенными микроорганизмами, в т.ч. иммунодефицитные состояния (например, больные, получающие или получавшие иммунодепрессанты. такие как митоксантрон или циклофосфамид, см. также раздел "Особые указания");
— одновременное применение интерферона бета или глатирамера ацетата;
— злокачественные новообразования, за исключением базальноклеточного рака кожи;
— дети и подростки.
Терапия Тизабри должна назначаться и находиться под постоянным контролем врачей, специализирующихся на диагностике и лечении неврологических заболеваний, в учреждениях, имеющих возможности проведения МРТ.
Пациентам, получающим Тизабри, необходимо выдать специальную карточку пациента и информировать о рисках данного препарата. Через 2 года лечения пациентов следует повторно проинформировать о рисках применения Тизабри, особенно о повышении риска ПМЛ. О ранних признаках и симптомах ПМЛ следует также информировать лиц, осуществляющих уход за пациентами.
В лечебных учреждениях должно быть все необходимое на случай развития реакций гиперчувствительности и оборудование для проведения МРТ.
После разведения раствор вводится в форме инфузий примерно в течение часа; во время инфузий и в течение часа после нее больные должны оставаться под наблюдением в связи с возможностью реакций гиперчувствительности.
Болюсное введение Тизабри не допускается.
При отсутствии нарушений, связанных с лечением, например, нейтропении, больных, получавших интерферон бета или глатирамера ацетат, можно непосредственно перевести на натализумаб. При наличии нарушений терапию натализумабом можно начинать только после того, как показатели вернуться в норму.
Некоторые больные могли ранее получать иммунодепрессанты (например, митоксантрон. циклофосфамид, азатиоприн). Эти лекарственные средства способны вызывать продолжительное иммунодепрессивное состояние, сохраняющееся даже после их отмены. Следовательно, перед назначением Тизабри необходимо убедиться в отсутствии иммунодефицита у больного.
При отсутствии признаков улучшения через 6 месяцев следует тщательно оценить целесообразность продолжения терапии.
Данные о безопасности и эффективности применения натализумаба за 2 года были получены из контролируемых, двойных слепых исследований. Решение о продлении терапии дольше этого срока должно приниматься только после оценки соотношения возможного риска и пользы.
Тизабри 300 мг вводится внутривенно в виде инфузии 1 раз в 4 недели.
Лица пожилого возраста
Применение Тизабри у пациентов старше 65 лет не рекомендуется из-за отсутствия данных о безопасности для этой категории больных.
Дети и подростки
Тизабри противопоказан детям и подросткам.
Больные с нарушением функции почек и печени
Исследований по оценке эффектов препарата при нарушенной функции печени и почек не проводилось.
Механизм выведения и результаты изучения фармакокинетики позволяют предположить, что препарат можно назначать больным с нарушенной функцией почек и печени без изменения дозы.
Эффективность и безопасность препарата при повторном введении не определяли.
Правила приготовления, введения, хранения и утилизации препарата
1. Перед разведением и введением осмотрите препарат на наличие твердых примесей. Не используйте препарат, содержащий твердые частицы или не соответствующий описанию "бесцветный, прозрачный или слегка опалесцирующий раствор".
2. Готовьте раствор для внутреннего введения в асептических условиях. Снимите верхнюю крышку с флакона. Проколите пробку в центре иглой шприца и отберите 15 мл концентрата для приготовления раствора для внутривенного введения.
3. Добавьте 15 мл концентрата к 100 мл 0,9 % раствора натрия хлорида. Осторожно переверните флакон несколько раз, чтобы перемешать содержимое. Не встряхивайте.
4. Не смешивайте Тизабри с другими растворителями и препаратами.
5. Перед введением осмотрите разведенный раствор на наличие твердых частиц или изменение цвета. Раствор с инородными примесями или изменением цвета непригоден для использования.
6. Разведенный препарат необходимо использовать как можно скорее и не поздее чем через 8 часов после разведения. Если раствор хранился при температуре 2-8°С (не был заморожен!), перед инфузией дайте ему нагреться до комнатной температуры.
7. Разведенный раствор вводится в виде инфузии в течение приблизительно 1 ч со скоростью около 2 мл/мин.
8. После завершения введения препарата промойте систему 0,9 % раствором натрия хлорида.
9. Каждый флакон предназначен только для одноразового использования.
10. Любой неиспользованный продукт или отходы следует утилизировать в соответствии с местными требованиями.
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Неврология №6 (52) | 2014
В статье обобщен опыт применения натализумаба (препарата, изменяющего течение рассеянного склероза), накопленный в Научном центре неврологии в 2012–2014 гг. Проанализированы эффективность, безопасность и переносимость натализумаба. Отмечается, что натализумаб хорошо переносится и оказывается эффективным в случаях активного течения демиелинизирующего процесса и в случаях неэффективности препаратов, изменяющих течение рассеянного склероза, первой линии. Подчеркивается необходимость обязательного соблюдения плана минимизации рисков побочных эффектов терапии. Рассматривается тактика ведения пациентов после прекращения лечения натализумабом.
В статье обобщен опыт применения натализумаба (препарата, изменяющего течение рассеянного склероза), накопленный в Научном центре неврологии в 2012–2014 гг. Проанализированы эффективность, безопасность и переносимость натализумаба. Отмечается, что натализумаб хорошо переносится и оказывается эффективным в случаях активного течения демиелинизирующего процесса и в случаях неэффективности препаратов, изменяющих течение рассеянного склероза, первой линии. Подчеркивается необходимость обязательного соблюдения плана минимизации рисков побочных эффектов терапии. Рассматривается тактика ведения пациентов после прекращения лечения натализумабом.
Таблица 1. Клинические характеристики пациентов на момент назначения препарата Тизабри
Таблица 2. Количество выполненных инфузий на момент отмены препарата и на момент выявления JCV- антител
Таблица 3. Клинические данные по течению рассеянного склероза в первый год после отмены Тизабри
Рисунок. Сумма баллов по шкале EDSS на момент назначения Тизабри, на момент прекращения терапии и через год после отмены препарата (нумерация клинических случаев как в таблице 1)
Рассеянный склероз – хроническое прогрессирующее демиелинизирующее заболевание центральной нервной системы. Рассеянным склерозом страдают преимущественно люди молодого возраста, трудоспособные и социально активные. Более половины больных рассеянным склерозом через десять лет испытывают затруднения в выполнении профессиональных обязанностей, через 15 лет имеют проблемы в самостоятельном передвижении, через 20 лет и дольше – трудности в самообслуживании [1].
Назначение препаратов, изменяющих течение рассеянного склероза (ПИТРС), преследует такие цели, как уменьшение риска развития обострений, стабилизация состояния, а именно замедление темпа нарастания инвалидизации и предотвращение трансформации в прогредиентное течение при ремиттирующем варианте болезни [2].
Ключевой проблемой в терапии, модулирующей течение рассеянного склероза, в настоящее время считается выработка критериев неэффективности лечения с целью своевременного перехода на другой вид терапии до того, как течение патологического процесса приведет к необратимому повреждению. Развитие обострений в течение первого года терапии, подтвержденное прогрессирование неврологического дефицита по расширенной шкале инвалидизации больных (Expanded Disability Status Scale – EDSS), сохранение или нарастание активности патологического процесса по данным магнитно-резонансной томографии (МРТ) могут быть расценены как комплекс признаков частичной или полной неэффективности лечения [3, 4].
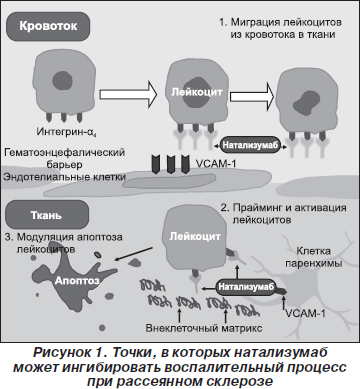
По мере углубления понимания процессов патогенеза рассеянного склероза появляется все больше «мишеней» для терапевтического воздействия. В настоящее время активно разрабатывается такая возможность терапии рассеянного склероза, как использование моноклональных антител, направленных на специфические антигены [5]. Антитела к молекулам адгезии могут ингибировать один из основных этапов патогенеза рассеянного склероза – взаимодействие с эндотелиальными клетками и миграцию лимфоцитов через гематоэнцефалический барьер. Первым из таких препаратов, прошедших клинические исследования при рассеянном склерозе, стал натализумаб – гуманизированное моноклональное антитело, связывающееся с альфа-4-субъединицей альфа-4-бета-1- и альфа-4-бета-7-интегрина, компонента интегрина very late antigen 4 (VLA-4) на лейкоцитах. Связывание натализумаба с VLA-4 блокирует его взаимодействие с лигандом адгезивных молекул сосудистой стенки (vascular cell adhesion molecule) на поверхности эндотелиальных клеток гематоэнцефалического барьера, что уменьшает миграцию лимфоцитов и моноцитов из венул и капилляров в воспалительные очаги. Натализумаб также способен снижать выраженность текущего воспалительного процесса в центральной нервной системе, опосредованного уже имеющимися в нервной ткани лимфоцитами.
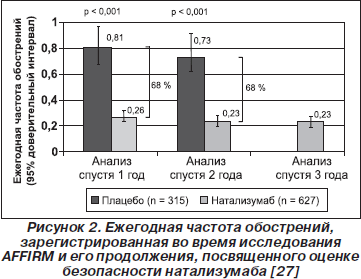
Тизабри (натализумаб) – первый препарат из группы моноклональных антител, доказавший эффективность при рассеянном склерозе в рандомизированных контролируемых исследованиях. Так, пациенты в исследовании AFFIRM получали 300 мг натализумаба внутривенно капельно каждые четыре недели. На фоне приема натализумаба значительно снизилась частота обострений (на 68%) и замедлилось прогрессирование инвалидизации (на 54%) по сравнению с плацебо. Данные изменения в большей степени были характерны для пациентов с активным течением рассеянного склероза (81 и 64% соответственно). Снижение активности патологического процесса наблюдалось также и на МРТ: на 83% уменьшилось среднее количество новых/увеличивающихся очагов и на 92% – количество очагов, накапливающих контрастное вещество. У 64% пациентов не было признаков клинической активности, у 57% – признаков активности по МРТ, у 37% не было ни клинических, ни радиологических признаков активности [6].
На настоящий момент натализумаб рекомендуется в качестве монотерапии при ремиттирующем рассеянном склерозе без признаков вторичного прогрессирования при неэффективности препаратов первой линии (интерферона бета, глатирамера ацетата) [3] либо при агрессивном течении ремиттирующего рассеянного склероза.
В России данный препарат зарегистрирован в 2010 г. для лечения ремиттирующего рассеянного склероза, а с 2011 г. проводится наблюдательная программа «Совет», целью которой является оценка безопасности и эффективности натализумаба в российской популяции пациентов [7]. В настоящей статье представлен опыт использования натализумаба, накопленный в Научном центре неврологии в 2012–2014 гг.
Материал и методы
В период с января 2012 г. по настоящий момент в Научном центре неврологии препарат Тизабри был назначен 12 пациентам, отвечающим следующим критериям:
Основные клинические характеристики пациентов представлены в таблице 1. Препарат получали равное количество женщин и мужчин (по шесть человек). Медиана возраста набранной группы составила 33 [28; 40] (21; 50) года*. Медиана длительности заболевания на момент начала терапии – 48 [23; 84] (6; 204) месяцев. Медиана тяжести по шкале EDSS на момент начала терапии – 3,75 [2,5; 5,5] (1,5; 6,0) балла, медиана индекса прогрессирования заболевания (соотношение суммы баллов по шкале EDSS и длительности заболевания) – 0,09 [0,05; 0,13] (0,02; 0,6).
Среди пациентов, включенных в программу, 50% ранее применяли ПИТРС первой линии с недостаточной эффективностью. Введение препарата Тизабри выполнялось по стандартной схеме в стационарных условиях шестого неврологического отделения Научного центра неврологии.
Результаты и их обсуждение
Из 12 пациентов, получавших Тизабри, четверо продолжают терапию по настоящий момент, в восьми случаях введение Тизабри прекращено. Длительность терапии составила от 10 до 28 инфузий.
При оценке эффективности лечения прежде всего оценивалась частота обострений. В пролеченной группе обострения на фоне терапии были отмечены только у двух пациентов: в одном случае обострение было зафиксировано на следующий день после первого введения препарата, в другом случае – после 13-й инфузии. Эти обострения купировались при проведении пульс-терапии метилпреднизолоном по стандартной схеме. Приведенные данные свидетельствуют о высокой эффективности натализумаба в отношении контроля активности патологического процесса при его назначении в качестве как первой, так и второй линии терапии, изменяющей течение рассеянного склероза.
Безопасность и переносимость натализумаба
Обсуждая вопросы безопасности и переносимости препарата Тизабри, следует отметить, что к побочным эффектам подобной терапии относят реакции на инфузию (головокружение, тошнота, крапивница, озноб), реакции гиперчувствительности (гипотензия, ощущение дискомфорта за грудиной, одышка, ангионевротический отек, сыпь, крапивница), изменения лабораторных показателей (повышение уровня печеночных трансаминаз, снижение гемоглобина и эритроцитов, повышение числа лейкоцитов), инфекции (простой герпес, опоясывающий герпес), в том числе оппортунистические. В нашем наблюдении нежелательные реакции были зарегистрированы один раз и расценены как реакции на инфузию препарата: один пациент после выполнения первой инфузии в течение нескольких часов испытывал тошноту и головокружение. В остальном Тизабри переносился хорошо, других побочных эффектов не отмечено.
Как известно, одним из серьезных побочных эффектов терапии является прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ). ПМЛ возникает в результате активации вируса Джона Каннингема (John Cunningham virus – JCV). При этом отмечается диффузная неуклонная воспалительная демиелинизация с формированием сливных очагов в белом и сером веществе головного мозга. До настоящего времени ПМЛ является потенциально летальным заболеванием. Обязательным условием назначения Тизабри является жесткое соблюдение плана минимизации риска развития ПМЛ. При подозрении на ПМЛ курс лечения рекомендуется немедленно прекратить [8].
К факторам риска развития ПМЛ относятся применение иммуносупрессивной терапии в анамнезе, наличие JCV-антител, длительность терапии натализумабом более двух лет. В наблюдаемой группе ни один пациент ранее не получал терапию митоксантроном. В то же время JCV-антитела выявлены у восьми пациентов. Количество выполненных инфузий в случае отмены препарата, число инфузий на момент выявления JCV-антител представлены в таблице 2.
В последнее время проводится не только качественный анализ наличия JCV-антител, но и количественное определение индекса антител, что позволяет оценить риск развития ПМЛ. Индекс демонстрирует оптическую плотность образца, нормализованного в калибраторе, который является итоговым показателем титра антител при серийном разведении. Для сопоставления приведем следующие данные: при индексе ? 0,9 и длительности терапии 1–24 месяца риск развития ПМЛ составляет 0,1 на 1000 пациентов, а при индексе > 1,5 при аналогичной продолжительности терапии – 1,0 на 1000 пациентов, то есть возрастает в 10 раз [9].
Таким образом, на фоне применения натализумаба важно оценивать JCV-антитела в динамике: в проведенных исследованиях рекомендовано обращать внимание на изменение статуса пациента с серонегативного на серопозитивный. Важно отметить, что применение натализумаба не противопоказано при наличии JCV-антител, так как это не единственный фактор риска развития ПМЛ. Около 55% пациентов с рассеянным склерозом являются серопозитивными по JCV [10], что сопоставимо с популяцией здоровых лиц [11].
В наблюдаемой группе в большинстве случаев мы продолжали терапию Тизабри, доведя количество инфузий до 12, как в случае отрицательного, так и положительного результата теста на JCV-антитела. В клиническом случае № 6 терапия была прервана после 10 инфузий ввиду высокого нарастания значения индекса антител в динамике (с 2,8 до 3,72 за семь месяцев). В остальных случаях также учитывалась сероконверсия. В случаях № 9 и 10 было выполнено более 12 инфузий при положительном тесте на JCV-антитела на момент назначения препарата ввиду высокой активности заболевания, молодого возраста пациенток, их желания продолжать терапию Тизабри. В этих двух случаях терапия была позже прервана по желанию пациенток (планируемая беременность в одном случае и желание отменить препарат без уточнения причины в другом).
Тактика ведения пациентов в случае прекращения терапии натализумабом
Наконец, еще одним крайне актуальным вопросом на сегодняшний день является течение болезни, возврат активности и тактика ведения пациентов в случае прекращения терапии натализумабом. В настоящее время активно разрабатывается оптимальная тактика ведения пациентов после отмены натализумаба по тем или иным причинам.
Опубликованы результаты анализа, в котором оценивали, как прекращение терапии натализумабом влияет на клиническую активность (частота обострений)
у 1866 пациентов и МРТ-активность (количество накапливающих контрастное вещество очагов) у 341 пациента с ремиттирующим рассеянным склерозом за восемь месяцев наблюдения. Было показано, что оба параметра активности патологического процесса увеличиваются после прекращения указанной терапии, достигая пика между четвертым и седьмым месяцами. Возврат активности болезни не зависит от длительности терапии натализумабом, перевода пациента на альтернативную терапию, а также отмечается у пациентов с высокой активностью рассеянного склероза [12]. Однако феномен рикошета по частоте обострений или активности накапливающих контраст очагов отмечен не был.
Согласно результатам другого когортного исследования, у 375 больных рассеянным склерозом с высокой активностью заболевания средняя частота развития обострений после прекращения терапии натализумабом может увеличиваться, но у большинства больных не достигает тех значений, которые были до начала терапии натализумабом. Для сравнения: частота обострений до начала терапии натализумабом составляла 0,94 (95%-ный доверительный интервал (ДИ) 0,88–1,00), во время терапии натализумабом 0,47 (95% ДИ 0,43–0,52), на первом – шестом месяце после отмены натализумаба 0,63 (95% ДИ 0,51–0,76), на 7–12-м месяце 0,55 (95% ДИ 0,42–0,70). Другими словами, частота обострений после прекращения терапии натализумабом в целом по группе не превысила аналогичный показатель до начала терапии. Однако у 22% пациентов течение болезни после прекращения указанной терапии могло быть классифицировано как феномен рикошета по частоте обострений: частота обострений после отмены натализумаба была выше, чем до начала лечения. У этих же больных отмечена более высокая частота обострений и в период лечения натализумабом [13].
По данным ряда авторов, при наблюдении за 201 пациентом в течение 12 месяцев синдром отмены по активности заболевания отмечен в 11,9% случаев. При этом средняя частота обострений до терапии натализумабом была меньше и терапевтический ответ был хуже именно у тех пациентов, у которых в дальнейшем отмечался феномен рикошета, в сравнении с пациентами без данного феномена. Пациенты без синдрома отмены также чаще раньше переводились на альтернативную терапию [14].
Данные по течению рассеянного склероза в первый год после отмены Тизабри у пациентов, наблюдавшихся в Научном центре неврологии, приведены в таблице 3.
В случаях № 6 и 9 частые обострения после отмены Тизабри потребовали не только назначения метилпреднизолона по стандартной схеме, но и проведения высокообъемного плазмафереза из-за полученной высокой суммарной дозы метилпреднизолона (12–13 г) в течение последних месяцев. Важно отметить: в случаях диагностирования по МРТ выраженной активации патологического процесса (в клинических случаях № 7 и 8) обострения не были тяжелыми по неврологическому дефициту и хорошо поддавались терапии глюкокортикостероидными препаратами. В случаях № 2 и 10 в течение года наблюдения отмечалось постепенное нарастание неврологического дефицита, что соответствует вторично-прогредиентному течению заболевания. В остальных двух случаях (№ 3 и 12) обострений рассеянного склероза не зафиксировано (табл. 2).
Как видно из рисунка, в период терапии Тизабри отмечалось уменьшение выраженности неврологического дефицита, стабилизировалась сумма баллов по шкале EDSS. После же прекращения терапии сумма баллов по шкале EDSS либо несколько увеличилась (у восьми пациентов сумма баллов выросла на 0,5–1), либо осталась неизменной. Исключением стал случай № 2, когда в результате развития вторично-прогредиентного рассеянного склероза неврологический дефицит через год после отмены Тизабри стал превышать таковой на момент назначения препарата.
До настоящего времени не получено результатов рандомизированных исследований, позволяющих ответить на вопрос: «Что делать после прекращения терапии натализумабом?» По данным группы экспертов из Германии (Krankheitsbezogene Kompetenznetz Multiple Sklerose), делать перерыв в лечении или вводить метилпреднизолон один раз в месяц нецелесообразно, в отличие от переключения на другую линию терапии. Для перевода на терапию финголимодом необходимо выдержать восьминедельный интервал, в то время как лечение глатирамера ацетатом или интерферонами бета можно начинать непосредственно сразу после отмены натализумаба [15].
В Италии проведено сравнительное исследование продолжения терапии натализумабом после двух лет (24 введения) и отмены/замены на препараты первой линии. Феномена рикошета заболевания у пациентов, прекративших прием натализумаба, не отмечено. Однако в группе натализумаба клиническая и радиологическая активность рассеянного склероза была значительно ниже, чем у «переключенных» или «прекративших» терапию. Таким образом, по данным литературы, прекращение терапии натализумабом у пациентов с хорошим ответом на терапию может обсуждаться только при наличии высокого риска развития ПМЛ, при условии, что этот риск перевешивает пользу от продолжения терапии [16].
Из нашего собственного опыта применения Тизабри можно сделать следующие выводы. Препарат Тизабри хорошо переносится и оказывается эффективным в случаях активного течения демиелинизирующего процесса и в случаях неэффективности ПИТРС первой линии. В течение первых двух лет терапии у пациентов отмечена сероконверсия по JCV-антителам, у некоторых пациентов в сочетании со значительным нарастанием индекса JCV-антител, что, возможно, влияет на риск развития ПМЛ. В случае прекращения терапии натализумабом необходима четкая организация перевода пациента на другие ПИТРС.
Использование Тизабри не лишено риска, и долгосрочное его применение требует осторожности. При назначении новых, высокоселективных препаратов важно уделять внимание минимизации рисков. Оценка риска и пользы от применения того или иного препарата для лечения рассеянного склероза – сложный, но необходимый этап выбора терапевтической стратегии для конкретного пациента. Строгое соблюдение плана управления рисками – залог безопасности терапии.
1. Рассеянный склероз. Клиническое руководство / под ред. Е.И. Гусева, И.А. Завалишина, А.Н. Бойко. М. Реал тайм, 2011.
2. Переседова А.В. Завалишин И.А. Современное со- стояние проблемы рассеянного склероза // Анналы клинической и экспериментальной неврологии. 2009. № 1. С. 43–47.
3. Basic and escalating immunomodulatory treatments in multiple sclerosis: current therapeutic recommendations // J. Neurol. 2008. Vol. 255. № 10. P. 1449–1463.
4. Брюхов В.В. Куликова С.Н. Кротенкова М.В. и др. Современные методы визуализации в патогенезе рас- сеянного склероза // Анналы клинической и экспери- ментальной неврологии. 2013. № 3. С. 47–54.
5. Ивашкова Е.В. Петров А.М. Вотинцева М.В. и др. Современные этические аспекты проведения кли- нических исследований лекарственных средств у пациентов с рассеянным склерозом // Анналы кли- нической и экспериментальной неврологии. 2012. № 2. С. 32–37.
6. Polman C.H. O’Connor P.W. Havrdova E. et. al. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis // N. Engl. J. Med. 2006. Vol. 354. № 9. P. 899–910.
7. Попова Е.В. Брылев Л.В. Давыдовская М.В. Предварительные результаты наблюдательной про- граммы «Совет» по применению препарата натализу- маб для лечения больных ремиттирующим рассеян- ным склерозом // Журнал неврологии и психиатрии им. С.С. Корсакова. 2013. № 2. С. 79–82.
8. Захарова М.Н. Прогрессирующая мультифокальная лейкоэнцефалопатия (обзор литературы) // Журнал неврологии и психиатрии им. С.С. Корсакова. 2012. № 9. С. 29–34.
10. Tornatore C. Clifford D.B. Clinical vigilance for progressive multifocal leukoencephalopathy in the context of natalizumab use // Multiple Sclerosis. 2009. Vol. 15. Suppl. 4. P. 16–25.
11. Egli A. Infanti L. Dumoulin A. et. al. Prevalence of polyomavirus BK and JC infection and replication in 400 healthy blood donors // J. Infect. Dis. 2009. Vol. 199. № 6. P. 837–846.
12. O’Connor P.W. Goodman A. Kappos L. et al. Disease activity return during natalizumab treatment interruption in patients with multiple sclerosis // Neurology. 2011. Vol. 76. P. 1858–1865.
13. Sorensen P.S. Koch-Henriksen N. Petersen T. et. al. Recurrence or rebound of clinical relapses after discontinuation of natalizumab therapy in highly active MS patients // J. Neurol. 2014. Vol. 261. № 6. P. 1170–1177.
14. Salhofer-Polanyi S. Baumgartner A. Kraus J. et al. What to expect after natalizumab cessation in a real-life setting // Acta Neurol. Scand. 2014. Vol. 130. № 2. P. 97–102.
15. Havla J. Kleiter I. Kumpfel T. Bridging, switching or drug holidays – how to treat a patient who stops natalizumab? // Ther. Clin. Risk Manag. 2013. Vol. 9. P. 361–369.
16. Clerico M. Schiavetti I. de Mercanti S.F. et al. Treatment of relapsing-remitting multiple sclerosis after 24 doses of natalizumab evidence from an Italian spontaneous, prospective, and observational study (the TY-STOP Study) // JAMA Neurol. 2014. Vol. 71. № 8. P. 954–960.
Experience of Using Natalizumab (Tysabri) at the Research Center of Neurology
A.A. Vorobyeva, T.O. Simaniv, M.N. Zakharova, I.A. Zavalishin, A.V. Peresedova
Research Center of Neurology
Contact person: Anastasiya Vyacheslavovna Peresedova, a.v.peresedova@mail.ru
Here, we sum up the experience of using natalizumab (a drug that alters course of multiple sclerosis) that
has been collected at the Research Center of Neurology during 2012–2014. Efficacy, safety and tolerability
of using natalizumab were analyzed. It is noted that natalizumab is well tolerated and turned out to be effective in case of active course of demyelinating process as well as when the first line-drugs altering course of multiple sclerosis were ineffective. It is emphasized a need to follow a plan for minimizing risks of side effects caused by therapy. A tactics for patient management after completing treatment with natalizumab is discussed.
Иммунодепрессивный препарат, применяемый при рассеянном склерозе.
Показания и дозировка:Для монотерапии ремиттирующей формы рассеянного склероза следующим группам больных:
Пациентам с активным течением заболевания, несмотря на лечение интерфероном бета. Данная группа пациентов, может быть определена как группа пациентов не поддающихся лечению полным и адекватным курсом (по крайней мере в течение одного года) интерферона бета. У них должно быть не менее одного рецидива в течение предыдущего года терапии и не менее 9 Т2-гиперинтенсивных очагов на магнитно-резонансной томографии головного мозга (МРТ) или не менее одного очага, видимого при применении контрастных средств для МРТ, содержащих гадолиний. Под пациентами "без ответа" на проводимую терапию следует понимать пациентов с неизменной или увеличенной частотой обострений по сравнению с предыдущим годом, либо текущими тяжелыми обострениями даже при лечении продолжительностью менее года;
Пациентам с быстро прогрессирующим тяжелым ремиттирующим рассеянным склерозом (т.е. перенесшим 2 или большее число обострений в течение года и имеющим 1 и более очагов на МРТ головного мозга, накапливающих контрастные средства для МРТ, содержащих гадолиний, либо значительное увеличение объема поражения в режиме Т2 по сравнению с результатами предыдущей МРТ).
Терапия Тизабри должна назначаться и находиться под постоянным контролем врачей, специализирующихся на диагностике и лечении неврологических заболеваний, в учреждениях, имеющих возможности проведения МРТ.
Пациентам, получающим Тизабри, необходимо выдать специальную карточку пациента и информировать о рисках данного препарата. Через 2 года лечения пациентов следует повторно проинформировать о рисках применения Тизабри, особенно о повышении риска ПМЛ. О ранних признаках и симптомах ПМЛ следует также информировать лиц, осуществляющих уход за пациентами.
В лечебных учреждениях должно быть все необходимое на случай развития реакций гиперчувствительности и оборудование для проведения МРТ.
После разведения раствор вводится в форме инфузий примерно в течение часа; во время инфузий и в течение часа после нее больные должны оставаться под наблюдением в связи с возможностью реакций гиперчувствительности.
Болюсное введение Тизабри не допускается.
При отсутствии нарушений, связанных с лечением, например, нейтропении, больных, получавших интерферон бета или глатирамера ацетат, можно непосредственно перевести на натализумаб. При наличии нарушений терапию натализумабом можно начинать только после того, как показатели вернуться в норму.
Некоторые больные могли ранее получать иммунодепрессанты (например, митоксантрон, циклофосфамид, азатиоприн). Эти лекарственные средства способны вызывать продолжительное иммунодепрессивное состояние, сохраняющееся даже после их отмены. Следовательно, перед назначением Тизабри необходимо убедиться в отсутствии иммунодефицита у больного.
При отсутствии признаков улучшения через 6 месяцев следует тщательно оценить целесообразность продолжения терапии.
Данные о безопасности и эффективности применения натализумаба за 2 года были получены из контролируемых, двойных слепых исследований. Решение о продлении терапии дольше этого срока должно приниматься только после оценки соотношения возможного риска и пользы.
Тизабри 300 мг вводится внутривенно в виде инфузии 1 раз в 4 недели.
Лица пожилого возраста
Применение Тизабри у пациентов старше 65 лет не рекомендуется из-за отсутствия данных о безопасности для этой категории больных.
Дети и подростки
Тизабри противопоказан детям и подросткам.
Больные с нарушением функции почек и печени
Исследований по оценке эффектов препарата при нарушенной функции печени и почек не проводилось.
Механизм выведения и результаты изучения фармакокинетики позволяют предположить, что препарат можно назначать больным с нарушенной функцией почек и печени без изменения дозы.
Эффективность и безопасность препарата при повторном введении не определяли.
Правила приготовления, введения, хранения и утилизации препарата
1. Перед разведением и введением осмотрите препарат на наличие твердых примесей. Не используйте препарат, содержащий твердые частицы или не соответствующий описанию "бесцветный, прозрачный или слегка опалесцирующий раствор".
2. Готовьте раствор для внутреннего введения в асептических условиях. Снимите верхнюю крышку с флакона. Проколите пробку в центре иглой шприца и отберите 15 мл концентрата для приготовления раствора для внутривенного введения.
3. Добавьте 15 мл концентрата к 100 мл 0,9 % раствора натрия хлорида. Осторожно переверните флакон несколько раз, чтобы перемешать содержимое. Не встряхивайте.
4. Не смешивайте Тизабри с другими растворителями и препаратами.
5. Перед введением осмотрите разведенный раствор на наличие твердых частиц или изменение цвета. Раствор с инородными примесями или изменением цвета непригоден для использования.
6. Разведенный препарат необходимо использовать как можно скорее и не поздее чем через 8 часов после разведения. Если раствор хранился при температуре 2-8°С (не был заморожен!), перед инфузией дайте ему нагреться до комнатной температуры.
7. Разведенный раствор вводится в виде инфузии в течение приблизительно 1 ч со скоростью около 2 мл/мин.
8. После завершения введения препарата промойте систему 0,9 % раствором натрия хлорида.
9. Каждый флакон предназначен только для одноразового использования.
10. Любой неиспользованный продукт или отходы следует утилизировать в соответствии с местными требованиями.
Передозировка:О случаях передозировки не сообщалось.
Побочные эффекты:Во время плацебоконтролируемого исследования на 1617 больных PC, получавших натализумаб в течение 2 лет (плацебо 1135), нежелательные явления, приведшие к досрочному прекращению участия, наблюдались у 5,8% больных, получавших натализумаб (и 4,8% получавших плацебо). За 2 года исследования побочные явления отмечены у 43,5% больных, получавших натализумаб, и у 39,6% (нежелательные явления расцененные как связанные с лечением лечащим врачом), получавших плацебо. Частота побочных явлений в группе натализумаба была на 0,5% выше, чем в группе плацебо, как показано ниже. Реакции были обозначены предпочтительными терминами, взятыми из медицинского словаря для нормативно-правовой деятельности (MedDRA), в соответствии с системно-органными классами. Их частота была следующей: частые (>1/100, <1/10), редкие (>1/1000, <1/100).
В каждой группе нежелательные явления разделены по частоте:
Инфекции и инвазии: частые - инфекции мочевыводящих путей, назофарингит.
Нарушения со стороны иммунной системы: частые - крапивница; редкие - гиперчувствительность.
Нарушения со стороны нервной системы: частые - головная боль, головокружение.
Желудочно-кишечные нарушения: частые - рвота, тошнота.
Костно-мышечные нарушения и поражения соединительной ткани: частые - боль в суставах.
Общие нарушения и реакции в месте введения: частые - озноб, лихорадка, утомляемость.
Реакции на инфузию: по данным 2-летнего контролируемого клинического исследования на больных PC, явлениями, связанными с инфузией, считали побочные явления, возникающие во время инфузий или в течение 1 часа после ее завершения. Они наблюдались у 23,1% больных PC, получавших натализумаб (и у 18,7%, получавших плацебо). Явления, чаще наблюдавшиеся в группе натализумаба, включали головокружение, тошноту, крапивницу и озноб (см. ниже раздел "Реакции гиперчувствительности").
Реакции гиперчувствительности: по данным двухлетнего контролируемого клинического исследования на больных PC,
частота случаев гинерчувствительности достигла 4%. Анафилактические/анафилактоидные реакции отмечены менее чем у 1% больных, получающих Тизабри. Реакции гиперчувствительности обычно возникают во время инфузии или в течение часа после нее.
Иммуногенность: во время двухлетнего контролируемого клинического исследования антитела к натализумабу обнаружились у 10% больных PC. Циркулирующие антитела к натализумабу (двукратный положительный результат) обнаружены примерно у 6% больных. Однократный положительный результат отмечен еще у 4% больных. Циркулирующие антитела уменьшают эффективность Тизабри и повышают частоту реакций гиперчувствительности. Прочие реакции на инфузию, обусловленные циркулирующими антителами, включали озноб, тошноту, рвоту и "приливы" крови. При подозрении на циркулирующие антитела после примерно 6-месячной терапии либо в связи со снижением эффективности, либо при возникновении реакции на инфузию, следует сделать еще один анализ через 6 недель после первого положительного результата. Учитывая возможное снижение эффективности или повышение частоты реакций гиперчувствительности у больных с циркулирующими антителами, лечение следует прекратить.
Инфекции, включая ПМЛ и инфекции условно-патогенными микроорганизмами: по данным двухлетнего контролируемого клинического исследования на больных PC частота инфекций была приблизительно 1,5 на пациенто-год как в группе натализумаба, так и в группе плацебо. Природа инфекций в обеих группах была примерно сходной. Сообщалось о случае диареи, обусловленной Cryptosporidium. Во время других клинических исследований отмечены другие условно-патогенные инфекции, в том числе смертельные случаи. Во время клинических исследований в группе, получавшей натализумаб, отмечена немного большая частота герпесвирусной инфекции (вирус опоясывающего герпеса и вирус простого герпеса), чем в группе, получавшей плацебо. В ходе раннего постмаркетингового наблюдения зарегистрирован один смертельный случай герпесвирусного энцефалита.
Большая часть больных, у которых развились инфекции, не прекратила терапию натализумабом и при соответствующем лечении наступаю выздоровление.
Во время клинических исследований зарегистрированы также случаи ПМЛ. Обычно они приводили к серьезной инвалидности или смерти. Во время базовых клинических исследований зарегистрировано два случая, включая один смертельный, у больных PCс сопутствующей инфекцией, получавших лечение интерфероном бета более 2 лет. В другом испытании ПМЛ развилась у пациента с болезнью Крона, длительно лечившегося иммунодепрессантами и страдавшего лимфопенией, этот пациент умер. Развитие ПМЛ отмечалось в постмаркетинговом исследовании у пациентов, получавших Тизабри в виде монотерапии.
Реакции со стороны печени: за период постмаркетингового наблюдения были получены спонтанные сообщения о случаях серьезного поражения печени, повышении активности «печеночных ферментов» и гипербилирубинемни.
Злокачественные новообразования: на протяжении более чем 2 лет терапии не было отмечено каких-либо различий в частоте злокачественных новообразований в группах натализумаба и плацебо. Тем не менее, чтобы полностью исключить влияние натализумаба на частоту возникновения злокачественных новообразований, необходимы более длительные исследования.
Влияние на лабораторные показатели: лечение Тизабри сопровождается повышением количества лимфоцитов, моноцитов, эозинофилов, базофилов и ядерных форм эритроцитов в циркулирующей крови. Повышения концентрации нейтрофилов не наблюдалось. Повышение количества лимфоцитов, моноцитов, эозинофилов и базофилов достигает 35-140% по сравнению с исходным значением, но общее количество клеток остается в нормальных пределах. Во время терапии Тизабри отмечено небольшое снижение концентрации гемоглобина (среднее снижение 0,6 г/дл), гематокрита (среднее снижение 2%) и эритроцитов (среднее снижение 0,1?106/л). Обычно в течение 16 недель после последней дозы Тизабри все гематологические показатели возвращались к исходному значению и эти изменения не сопровождались клиническими симптомами.
Противопоказания:Гиперчувствительность к натализумабу или любому из вспомогательных веществ
Прогрессирующая многоочаговая лейкоэнцефалопатия (ПМЛ)
Повышенный риск инфекции условно-патогенными микроорганизмами, в т.ч. иммунодефицитные состояния (например, больные, получающие или получавшие иммунодепрессанты, такие как митоксантрон или циклофосфамид, см. также раздел)
Одновременное применение интерферона бета или глатирамера ацетата;
Злокачественные новообразования, за исключением базальноклеточного рака кожи
Дети и подростки
Не следует назначать натализумаб во время беременности без крайней необходимости. Если пациентка забеременеет во время приема Тизабри, терапию следует прекратить.
Тизабри выделяется с грудным молоком. Пациентки, получающие Тизабри, должны прекратить кормление грудью.
Взаимодействие с другими лекарствами и алкоголем:Безопасность и эффективность Тизабри в сочетании с другими иммунодепрессантами или противоопухолевыми препаратами пока недостаточно установлена. Сопутствующий прием этих препаратов может повысить риск инфекции, в том числе условно-патогенными микроорганизмами, и, следовательно, противопоказан.
У пациентов, ранее получавших терапию иммунодепрессантами, повышен риск развития ПМЛ. Назначать препарат больным, ранее получавшим иммунодепрессанты, следует с осторожностью; необходимо подождать восстановления функции иммунной системы. Перед назначением Тизабри лечащий врач должен оценить каждый отдельный случай, чтобы выявить возможные признаки иммунодефицита.
По результатам 3-ей фазы клинических исследований на больных PC, сопутствующее лечение рецидива кратковременным курсом глюкокортикостероидов не сопровождалось учащением случаев инфекций. Таким образом, кратковременную терапию глюкокортикостероидами можно проводить параллельно с терапией Тизабри.
Не следует смешивать Тизабри с другими лекарственными препаратами, за исключением 0,9 % раствора натрия хлорида.
В рандомизированных открытых исследованиях, проведенных с участием 60 пациентов с рассеянным склерозом, не было выявлено значимых отклонений в иммунном ответе пациентов на введенный антиген. Сравнение проводилось в группах пациентов, проходивших лечение препаратом Тизабри в течение 6 месяцев и контрольной группой, не получавшей лечение препаратом Тизабри.
Состав и свойства:1 мл натализумаб 20 мг
Вспомогательные вещества: натрия дигидрофосфата моногидрат, натрия гидрофосфата гептагидрат, натрия хлорид, полисорбат 80, вода д/и.
Концентрат для приготовления раствора для инфузий в виде бесцветного, прозрачного или слегка опалесцирующего раствора.
Препарат Тизабри содержит натализумаб - селективный ингибитор молекул адгезии. Тизабри связывается с ?4-субъединицей человеческого интегрина, в большом количестве экспрессирующегося на поверхности всех лейкоцитов, за исключением нейтрофилов. Натализумаб специфически связывается с ?4?1-интегрином, блокируя при этом взаимодействие с соответствующим рецептором, адгезивной молекулой клеток сосудов (VCAM-1) и лигандом остеопонтина, доменом фибронектина, образовавшимся в результате альтернативного сплайсинга, соединительным сегментом-1 (CS-1). Кроме этого, натализумаб блокирует взаимодействие ?4?7-интегрина с молекулой адгезии слизистой оболочки, адрессином-1 (MadCAM-1). Влияние на эти молекулярные взаимодействия препятствует миграции мононуклеарных лейкоцитов через эндотелий в очаги воспаления паренхиматозных органов. Дальнейший механизм действия натализумаба может быть обусловлен подавлением воспалительных реакций в пораженных тканях путем подавления взаимодействия ?4-экспрессирующих лейкоцитов с их лигандами во внеклеточном веществе и на клетках паренхимы. Таким образом натализумаб может подавлять воспалительную активность в пораженных тканях и дальнейшее привлечение иммунных клеток к очагу воспаления.
Повреждение тканей головного мозга при рассеянном склерозе (PC) происходит при переходе активированных Т-лимфоцитов через гематоэнцефалический барьер (ГЭБ). Миграция лейкоцитов через ГЭБ включает взаимодействие между молекулами адгезии на поверхности активированных лейкоцитов и эндотелием кровеносных сосудов. Взаимодействие между ?4?1 и его мишенями является важным компонентом патогенеза формирования очагов воспаления в головном мозге, поэтому нарушение этих взаимодействий снижает активность воспаления. При нормальных условиях VCAM-1 не экспрессируется в паренхиме головного мозга. Однако в присутствии провоспалительных цитокинов выработка VCAM-1 в клетках эндотелия и, возможно, в глиальных клетках, находящихся вблизи очага воспаления, регулируется по механизму положительной обратной связи. В условиях воспаления ЦНС при PC взаимодействие ?4?1 с VCAM-1, CS-1 и остеопонтином опосредует прочную адгезию и миграцию лейкоцитов в головном мозге и может усиливать воспалительный каскад в тканях ЦНС. Блокада молекулярных взаимодействий ?4?1 с его мишенями снижает воспалительную активность в паренхиме головного мозга при PC и подавляет дальнейшее привлечение иммунных клеток в очаги воспаления, тем самым снижая образование или замедляя увеличение объема поражения при PC.
Данные доклинического изучения безопасности
Многократно проведенные доклинические исследования по безопасности не показали каких-либо особых факторов риска для человека и генотоксичности.
В большинстве исследований in vivo было обнаружено изменение миграции лимфоцитов, что согласуется с фармакологической активностью натализумаба; отмечено повышение количества лейкоцитов и массы селезенки. Эти изменения были обратимы и не имели каких-либо видимых токсикологических последствий.
В исследованиях на мышах при введении натализумаба не отмечено ускорения деления клеток меланомы и лимфобластного лейкоза.
При исследовании методом Эймса или анализе на хромосомные аберрации, мутагенного эффекта при применении натализумаба у человека не выявлено. При исследовании пролиферации клеточных линий опухолей, содержащих ?4-интегрин, in vitro, не выявлено признаков цитотоксичности.
В исследовании на морских свинках с применением доз, превышающих рекомендованные для человека, не было выявлено влияния натализумаба на репродуктивную способность самцов.
Для оценки влияния натализумаба на репродуктивную функцию было проведено 5 исследований, 3 из них на морских свинках и 2 на обезьянах Cynomolgus. Эти исследования не показали тератогенных эффектов или влияния на рост потомства. В одном исследовании на морских свинках было отмечено незначительное снижение выживаемости детенышей. В исследовании на обезьянах в группе, получившей 30 мг/кг натализумаба частота самопроизвольных абортов увеличилась вдвое по сравнению с контрольной группой. Это явилось результатом высокой частоты самопроизвольных абортов в первой группе, что не наблюдалось во второй группе. В другом исследовании не было выявлено влияния на частоту самопроизвольных абортов. Исследование на беременных самках обезьян Cynomolgus показало влияние натализумаба на плод, включавшее полную анемию, снижение концентрации тромбоцитов, увеличение массы селезенки и снижение массы печени и тимуса. Эти изменения были связаны с повышением экстрамедуллярного кроветворения в селезенке, атрофией тимуса и снижением кроветворения в печени. Снижение концентрации тромбоцитов отмечено также у потомства самок, получавших натализумаб до родов, однако, признаков анемии у них не отмечено. Все изменения наблюдались при дозах, превышающих рекомендованную для человека и приходили в норму после прекращения приема натализумаба.
У некоторых самок обезьян Cynomolgus, получавших натализумаб до родов, отмечена незначительная концентрация натализумаба в молоке, что указывает на возможность выделения натализумаба с грудным молоком у женщин.
Хранить концентрат и готовый к применению раствор при температуре 2-8°С, в защищенном от света месте. Не замораживать. Хранить в недоступном для детей месте.
Срок годности: концентрат - 4 года, готовый к применению раствор - 8 часов. Не использовать по истечении срока годности.
ПОХОЖИЕ ПО ДЕЙСТВУЮЩЕМУ ВЕЩЕСТВУ