






 Рейтинг: 4.7/5.0 (1920 проголосовавших)
Рейтинг: 4.7/5.0 (1920 проголосовавших)Категория: Инструкции
При контроле за работой холодильного оборудования на 3-м уровне "холодовой цепи" следует обращать внимание на то, что:
не допускается получение МИБП со сроком годности меньше 1 месяца;
все виды МИБП хранят при температуре от 2 до 8 град. С в холодильниках, холодильных шкафах или холодильных камерах;
для замораживания необходимого количества хладоэлементов, в том числе и для чрезвычайных ситуаций, используют морозильники;
должно быть достаточное количество резервных, оборотных термоконтейнеров для транспортирования МИБП в организации, осуществляющие вакцинопрофилактику;
транспортирование МИБП на 3-й уровень осуществляют в термоконтейнерах;
получение МИБП на 3-м уровне и отгрузка на 4-й уровень осуществляется в максимально короткие сроки;
хранение МИБП проводится в холодильном оборудовании на стеллажах (полках) с гигиеническим покрытием, имеющих соответствующую маркировку, при условии свободной циркуляции охлажденного воздуха;
снабжение МИБП учреждения 3-го уровня и отпуск препаратов на 4-й уровень осуществляются в строгом соответствии с согласованными Роспотребнадзором на текущий год заявками на иммунобиологические препараты и планом иммунизации населения;
наличие конкретного плана действий в случае возникновения аварийных ситуаций (отключение электроэнергии, выход из строя холодильного оборудования и пр.);
должностное лицо, ответственное за "холодовую цепь", должно вести строгий учет поступлений и отправлений МИБП, контролировать показания термоиндикаторов (терморегистраторов), условия отпуска и транспортирования МИБП на 4-й уровень - в соответствии с требованиями действующих нормативно-методических документов;
разгрузка МИБП должна производиться в максимально сжатые сроки (5-10 мин).
При разгрузке МИБП ответственное должностное лицо фиксирует в журнале учета поступления и расхода МИБП дату поступления, наименование препарата (и соответствующего растворителя), его количество, контрольный номер, серию, срок годности, наименование фирмы-производителя, условия транспортирования, показания термоиндикатора. Выборочно проводится визуальный осмотр поступившей партии препарата (целость упаковки МИБП), а также наличие сопровождающих документов. При их отсутствии получатель не имеет право принять партию препаратов;
- специалисты, осуществляющие государственный санитарно-эпидемиологический надзор при плановой и внеплановой проверке медицинских организаций, контролируют порядок поступления, хранения и отпуска МИБП.
5.3. Контроль за работой 4-го уровня "холодовой цепи" (лпо)Организацию комплекса мероприятий, обеспечивающих оптимальные температурные условия при транспортировании и хранении МИБП на 4-м уровне "холодовой цепи", осуществляют руководители лечебно-профилактических организаций.
5.3.1. Контроль за работой холодильного оборудования
При контроле за работой холодильного оборудования на 4-м уровне "холодовой цепи" следует обращать внимание на то, что:
все виды МИБП хранят в холодильных шкафах или в бытовых холодильниках при температуре от 2 до 8 град. С, термометры размещают на верхней и нижней полках холодильника;
в морозильном отделении холодильников должен быть запас замороженных хладоэлементов;
длительность хранения медицинских иммунобиологических препаратов на 4-м уровне холодовой цепи не должна превышать одного месяца;
в труднодоступных районах срок хранения МИБП может быть увеличен до 3-х месяцев;
совместное хранение МИБП с другими медицинскими препаратами не допускается;
должен быть достаточный резерв холодильных сумок и хладоэлементов для доставки МИБП к местам проведения иммунизации;
загрузку или разгрузку термоконтейнеров (холодильных сумок) осуществляют в срок до 10 мин. (без учета времени, необходимого для кондиционирования хладоэлементов);
должностное лицо, ответственное за обеспечение "холодовой цепи", должно вести учет поступления и расхода МИБП, фиксировать показания термоиндикаторов (терморегистраторов), используемых для контроля температурного режима.
5.3.2. Контроль за помещениями для хранения МИБП
При контроле за помещениями для хранения МИБП необходимо обращать внимание:
на соответствие площади помещения габаритам используемого оборудования;
на наличие отопления (температура воздуха 18 град. С), вентиляции (кратность воздухообмена при механической вентиляции: приток - 2, вытяжка - 3, при естественном воздухообмене - 1), водоснабжения (подводка воды с установкой раковины);
на освещенность рабочих поверхностей не менее 150 ЛК, источник света - люминесцентные лампы или лампы накаливания;
на покрытие стен и пола материалами, выдерживающими режим многократной влажной уборки и дезинфекции;
на оборудование холодильниками с морозильными отсеками, рабочим столом, термоконтейнерами достаточной емкости, хладоэлементами, контейнером для мусора, емкостью для приготовления дезинфицирующего раствора;
на организацию и контроль за соблюдением дезинфекционного режима.
В помещении, где производится загрузка термоконтейнеров, должен быть предусмотрен стол для кондиционирования хладоэлементов.
5.3.3. Контроль закладки хладоэлементов в термоконтейнер
В ходе проверки провести опрос персонала на знание вопроса закладки хладоэлементов в термоконтейнер:
замороженные хладоэлементы по извлечении их из морозильника или морозильной камеры необходимо предварительно довести до температуры на поверхности хладоэлемента 0 град. С;
хладоэлементы должны быть выложены на стол с соблюдением следующих правил:
в один слой, не более чем в два ряда;
вокруг каждого хладоэлемента должно оставаться свободное пространство не менее 5 см;
подождать, пока внутри хладоэлемента не появится небольшое количество воды (хладоэлемент будет достаточно кондиционирован, т.е. готов к использованию, как только лед начнет слегка передвигаться внутри него).
5.3.4. Контроль за использованием МИБП
В небольших амбулаторно-поликлинических организациях для хранения МИБП может использоваться помещение прививочного кабинета. Хранение МИБП осуществляется в холодильниках, оснащенных термометрами, при температуре 2-8 град. С.
При контроле за использованием МИБП необходимо проверить:
хранятся ли МИБП в промышленной упаковке и обеспечен ли доступ охлажденного воздуха к каждой упаковке;
располагаются ли препараты одного наименования при хранении по сериям, с учетом срока годности;
используются ли в первую очередь вакцины, полученные раньше;
хранятся ли вакцины разных наименований в одном холодильнике на разных маркированных полках;
как хранится растворитель для вакцины (в прививочном кабинете растворитель для вакцины должен храниться в холодильнике при температуре 2-8 град. С, замораживание растворителя не допускается);
есть ли достаточный запас хладоэлементов в морозильной камере холодильника для одномоментной загрузки всех имеющихся в лечебно-профилактической организации термоконтейнеров;
не хранятся ли МИБП на дверной панели холодильника, что является грубым нарушением;
осуществляется ли контроль за температурным режимом хранения вакцин в холодильнике 2 раза в день, заносятся ли показания термометра должностным лицом в журнал регистрации температурного режима холодильника;
проводится ли выборочный визуальный контроль МИБП в процессе хранения не реже, чем один раз в месяц;
фиксируются ли факты аварийного или планового отключения холодильника в журнале регистрации температурного режима холодильника.
При аварийном или плановом отключении холодильника (на мойку) вакцины следует хранить в термоконтейнерах с хладоэлементами или в резервных холодильниках.
Хранившиеся в условиях нарушения "холодовой цепи" МИБП не должны использоваться и подлежат уничтожению в соответствии с действующими нормативными и методическими документами.
Хранение в холодильнике иных предметов или лекарственных препаратов не допускается.
Вакцина, приобретенная в аптечной организации по рецепту врача, может использоваться в прививочных кабинетах ЛПО, детских дошкольных образовательных организациях, медицинских кабинетах общеобразовательных учебных организаций (специальных образовательных организациях), здравпунктах и других медицинских организациях, независимо от организационно-правовых форм, имеющих лицензию на медицинскую деятельность, при строгом соблюдении условий ее хранения и транспортирования.
5.4. Контроль за получением, хранением и отпуском МИБП в аптечных организациях
Получение, хранение и отпуск гражданам МИБП в аптечных организациях, имеющих рецептурный отдел, осуществляется в соответствии с требованиями СП 3.3.2.1120-02. Через аптечные организации и организации здравоохранения реализуют только зарегистрированные и разрешенные к применению в установленном порядке отечественные и зарубежные МИБП. Аптечным киоскам и аптечным магазинам отпуск гражданам МИБП без рецепта врача не разрешается. Руководители аптечной организации и организации здравоохранения являются ответственными за обеспечение выполнения требований соблюдения "холодовой цепи" при транспортировании и хранении МИБП, а также при их обезвреживании.
При контроле за получением, хранением и отпуском МИБП в аптечных организациях необходимо проверить:
наличие сертификата производства и паспорта на каждую серию отечественного препарата и сертификата соответствия - для импортных МИБП;
соблюдение в аптечных организациях условий, гарантирующих сохранность их исходного качества, обеспечивающих защиту препаратов от воздействия неблагоприятной температуры окружающей среды, от повреждения упаковок, расплескивания и т.д.;
соответствие температурных условий при транспортировании и хранении МИБП в аптечных организациях инструкциям по применению конкретных препаратов;
не подверглись ли замораживанию адсорбированные препараты (вакцины против гепатита B, коклюшно-дифтерийно-столбнячные вакцины, дифтерийно-столбнячные анатоксины и др.) при транспортировании и хранении;
выдается ли пациентам вакцина в аптечной организации строго по рецепту врача лечебно-профилактической организации (независимо от организационно-правовой формы), с указанием на упаковке даты и времени продажи, выдачей чека, инструкции по ее применению на русском языке и при условии доставки препарата до места непосредственного использования с соблюдением "холодовой цепи" (в термоконтейнере или термосе со льдом);
наличие в аптечных организациях, осуществляющих отпуск МИБП гражданам, следующих документов для учета поступления и расхода МИБП:
журнала учета поступления и расхода МИБП;
накладных на приобретение МИБП;
инструкций по применению МИБП на русском языке;
актов об уничтожении МИБП;
актов проверки условий хранения, учета и расходования МИБП специалистами органов, осуществляющих государственный санитарно-эпидемиологический надзор;
отпуск покупателям препарата и доставка его в лечебно-профилактическую организацию осуществляется в минимальные сроки (не более 48 ч.) после приобретения препарата при условии хранения и доставки последнего в термоконтейнере (термосе со льдом) или сумке-холодильнике при температуре 2-8 град. С.
Учитывая разнообразие сфер предназначения, термоконтейнеры могут изготавливаться из самых различных материалов. Пищевые и медицинские емкости чаще всего выполняются из полиуретана, пенополистирола, вспененного полиуретана и других пластмасс. Материал и форма изготовления транспортировочной тары обусловлены небольшими объемами партий. Но они же имеют дополнительное требование санитарных служб – контроль физико-химического состояния препарата или продукта. Достигается это с помощью специальных датчиков и приборов, установленных в контейнер. Наиболее распространенные формы изготовления тары: боксы, сумки, контейнеры, термосы. Свойства тары могут ограничиваться изотермическими, могут быть добавлены функции охлаждения вещества, контроллеры состояния.
Наше предприятие производит, поставляет и обслуживает медицинские термические контейнеры, термоконтейнеры для продуктов. Объем предложенной тары – от двух литров до семидясити пяти. Функциональность емкостей не ограничивается применением в медицинских целях. Возможно использование контейнеров для пищевых продуктов и бытовых целей. Популярно применение в качестве автомобильного термоизолятора. Небольшие объемы дают возможность применять их для транспортировки мелких партий товаров. Материал изготовления также рассчитан на бытового потребителя – это пенополиуретан или облегченный полиуретан. Оснащение изделий предполагает ручки для переноса на плечах, в руках. Для дополнительной установки холодильного агрегата в контейнер предусмотрены холодильные элементы и аккумуляторы. В противном случае контейнер способен сохранять исходную температуру в течение указанного в инструкции времени. Специальный термический индикатор при этом позволяет произвести контроль состояния вещества в таре.
Следовательно, для адекватного подбора емкости и оснащения необходимо рассмотреть и учесть условия ее эксплуатации, прямые и косвенные задачи. В сочетании с правильным выбором гарантии производителя и соответствие продукции евростандартам позволят решить проблему температурной изоляции продуктов и веществ при перевозке.
Приказ Минздрава РФ от 21.03.2003 N 109 (ред. от 29.10.2009) «О совершенствовании противотуберкулезных мероприятий в Российской Федерации»
МУ 3.3.1889-04. 3.3. Иммунопрофилактика инфекционных болезней. Порядок проведения профилактических прививок. Методические указания (утв. Главным государственным санитарным врачом РФ 04.03.2004)
Постановление Главного государственного санитарного врача РФ от 22.07.2010 N 91 (ред. от 20.12.2010) Об утверждении СанПиН 2.4.1.2660-10 «Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы в дошкольных организациях» (вместе с «СанПиН 2.4.1.2660-10. Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы в дошкольных организациях. Санитарно-эпидемиологические правила и нормативы»)
Постановление Главного государственного санитарного врача РФ от 21.01.2011 N 10 «Об утверждении СП 3.1.7.2836-11 «Изменения и дополнения N 1 к СП 3.1.7.2616-10 «Профилактика сальмонеллеза»
Постановление Главного государственного санитарного врача РФ от 27.07.2011 N 106 «Об утверждении СП 3.1.2950-11 «Профилактика энтеровирусной (неполио) инфекции»
Постановление Главного государственного санитарного врача РФ от 28.07.2011 N 107 «Об утверждении СП 3.1.2951-11 «Профилактика полиомиелита»
Постановление Главного государственного санитарного врача РФ от 28.07.2011 N 108 «Об утверждении СП 3.1.2952-11 «Профилактика кори, краснухи и эпидемического паротита»
11 декабря 2012, 08:22

«Холодовой цепью» называют систему, обеспечивающую необходимые условия хранения и транспортировки иммунобиологических препаратов от предприятия-изготовителя до пациента. Холодовая цепь является важным элементом иммунопрофилактики, т.к. все вакцины теряют свою активность со временем, особенно вследствие воздействия тепла, а некоторые и вследствие замораживания. Соблюдение и поддержание правильного температурного режима во время хранения и транспортировки вакцин, является главной задачей для медицинских работников.
Все вакцины теряют свою активность при хранении при повышенной температуре, однако, их чувствительность к высоким температурам различна. Наиболее термочувствительными являются полиомиелитная, коревая, коклюшная (бесклеточная), паротитная, АКДС, АДС, АДС-М, БЦЖ, вакцина против гепатита В. Столбнячный анатоксин (АС) менее чувствителен к повышению температуры.
Вакцины варьируют также по чувствительности к низкой температуре: одни могут переносить замораживание без потери активности (полиомиелитная, коревая, паротитная вакцины), другие разрушаются при замораживании (АКДС, АДС, АДС-М, АС, вакцина против гепатита В).
Прочтите также статью Хранение вакцин в прививочном кабинет е Система «Холодовой цепи» включает :1) специально обученный персонал, обеспечивающий эксплуатацию холодильного оборудования, правильное хранение и транспортировку вакцин;
2) холодильное оборудование, предназначенное для хранения и транспортировки вакцин в оптимальных температурных условиях;
3) механизм контроля над соблюдением требуемых температурных условий на всех этапах хранения и транспортировки вакцин.
Необходимые условия транспортировки и хранения вакцин1. Приоритет режимов хранения и транспортировки устанавливает инструкция по применению препарата. Для сохранения и транспортировки большинства вакцин необходимы условия от +0 до +8ºС. Исключение составляют ОПВ, коревая и паротитная вакцины, которые должны храниться при температуре от-15 до -25ºС.
2. Защищенное от света место
3. Категорически запрещается замораживание вакцин на основе АКДС и с содержанием гепатита В
4. С лиофилизированными препаратами должен применяться только растворитель фирмы-производителя
5. Вакцины всегда надо перевозить в герметичных термоизолирующих контейнерах с достаточным количеством льда для обеспечения температурного режима.
17.1. При транспортировании и хранении медикобиологической продукции должны быть соблюдены условия, обеспечивающие сохранность исходного качества препаратов; препараты должны быть предохранены от воздействия изменяемой температуры окружающей среды, от разрушения и повреждения упаковок, расплескивания и т.д.
17.2. Транспортирование и хранение должно проводиться при соблюдении специальной системы "холодовой цепи".
Холодовая цепь - это бесперебойно функционирующая система, обеспечивающая оптимальный температурный режим хранения и транспортирования вакцин и других иммунобиологических препаратов на всех этапах пути их следования от предприятия-изготовителя до вакцинируемого.
17.3. Оптимальной для хранения и транспортирования вакцин и других иммунобиологических препаратов является температура в пределах 0-/+8 град. С. В случае необходимости длительного хранения живых вирусных вакцин (против кори, паротита и полиомиелита) рекомендуется их содержание в замороженном виде, т.е. при температуре -20 град. С. Категорически не допускается замораживание адсорбированных препаратов (вакцин АДС, АКДС и др.). При определении режима хранения и транспортирования других вакцин следует руководствоваться инструкциями, которые прилагаются к препарату.
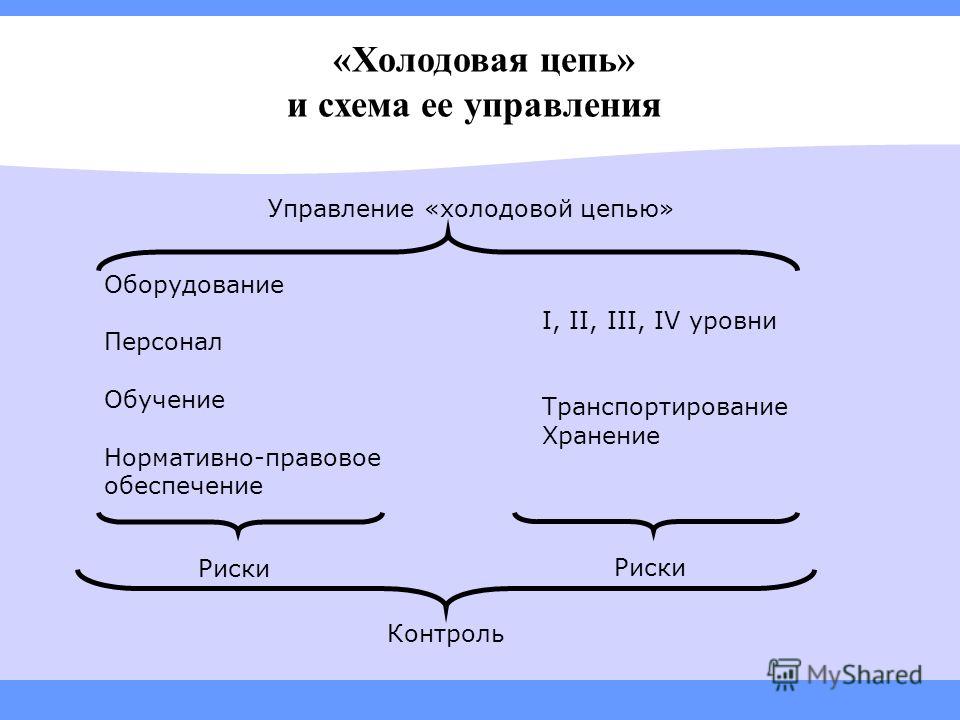
17.4. Основными компонентами холодовой цепи являются:
специально обученный персонал, обеспечивающий обслуживание холодильного оборудования, правильное хранение вакцин и снабжение ими нижестоящих структурных подразделений;
холодильное оборудование, предназначенное для хранения и транспортирования вакцин в оптимальных температурных условиях;
механизм контроля за соблюдением требуемого температурного режима на всех этапах холодовой цепи.
17.5. В системе холодовой цепи имеются следующие уровни (см. приложение 2):
1-й уровень - предприятие - изготовитель вакцин и других иммунобиологических препаратов;
2-й уровень - республиканские, краевые, областные аптечные склады и склады ЦГСЭН;
3-й уровень - городские и районные (городские и сельские) аптечные склады или склады ЦГСЭН;
4-й уровень - лечебно - профилактические учреждения (участковые больницы, амбулатории, детские поликлиники, родильные дома, фельдшерско - акушерские пункты и др.).
17.6. На всех уровнях холодовой цепи должна строго проводиться регистрация поступлений и дальнейшего отправления вакцин и других иммунобиологических препаратов в нижестоящие учреждения с фиксацией наименования препарата, его количества и серии, срока годности, даты поступления (отправления), условий хранения и транспортирования, показателей термоиндикаторов, ф. и. о. ответственного работника. Кроме того, на всех уровнях холодовой цепи необходимо регулярно (не реже 2 раз в сутки) в специальном журнале отмечать температуру, при которой хранится тот или иной препарат, с указанием ответственного лица за эту работу.
17.7. На всех этапах холодовой цепи должны работать специально назначенные в приказном порядке специалисты с четким определением их служебных обязанностей в соответствии с занимаемой должностью и объемом работы.
17.8. В каждом учреждении, где хранятся иммунобиологические препараты, независимо от их количества, должен быть утвержденный его руководителем план экстренных мероприятий на случай возникновения непредвиденных проблем в холодовой цепи в этом учреждении.
17.9. При хранении вакцин следует соблюдать ряд общих правил:
вакцина (вакцины) должна располагаться таким образом, чтобы к каждой ее упаковке был доступ охлажденного воздуха;
вакцина (вакцины) должна располагаться так, чтобы препарат, имеющий меньший срок годности, использовался в первую очередь;
в холодильниках (при температуре 0-/+8 град. С) следует хранить БЦЖ и другие неадсорбированные и адсорбированные вакцины. Живые вакцины, которые согласно инструкции по применению требуют хранения в замороженном состоянии, должны храниться в морозильной камере при температуре -20 град. С. Для таких препаратов допускается временное, не более 48 ч, повышение температуры до 0-/+8 град. С при транспортировке.
17.10. При невыполнении требований настоящих правил на том или ином уровне холодовой цепи получатель имеет право потребовать составления соответствующего акта и либо отказаться от получения вакцины (в случае грубого нарушения режима хранения или транспортирования), либо, в случае возникших сомнений относительно его качества, потребовать проверки его качества за счет направляющей стороны. Ответственность за соблюдение режима хранения вакцин у потребителя лежит на специалистах, которые отвечают за это в соответствии с должностными обязанностями.
17.11. Первый уровень холодовой цепи.
Первым уровнем холодовой цепи является предприятие - изготовитель, независимо от своего территориального расположения.
На этом уровне вакцина до отправки должна храниться:
живые вирусные (коревая, паротитная, полиомиелитная и др.) при температуре не выше -20 град. С, т.е. в замороженном виде;
другие вакцины при температуре 0-/+8 град. С (согласно утвержденной инструкции по их применению).
Для хранения вакцин на этом уровне, в зависимости от вида и количества препарата, могут использоваться морозильные и холодильные камеры, морозильники и холодильники, холодильные шкафы. Для заготовки необходимого количества хладоэлементов используются морозильники.
Отправка вакцин и других иммунобиологических препаратов должна осуществляться в термоконтейнерах в сопровождении соответствующего термоиндикатора или авторефрижераторным транспортом при температуре 0-/+8 град. С, контроль которой обеспечивать прилагаемым термоиндикатором.
--------------------------------
- Вводится с 01.01.1995 г.
Термоконтейнер представляет собой ящик, изготовленный из полистирола или полиуретана с герметически закрывающейся крышкой из того же материала. Обычно этот ящик помещается в картонную коробку, что предохраняет его от быстрой порчи. На коробку наносится цветная этикетка: "Вакцина! Срочный груз!", "Боится замораживания!". Температура в термоконтейнерах, которая достигается благодаря помещению в его полость хладоэлементов, должна сохраняться в течение минимум 48 ч в пределах от 0 до +8 град. С при температуре внешней среды +43 град. С. Размеры термоконтейнера могут варьироваться.
Хладоэлемент представляет собой пластмассовую емкость прямоугольной формы, герметически закрывающуюся пробкой. Наполненные до определенной метки водой и замороженные в течение суток, при помещении в термоконтейнер хладоэлементы создают в нем определенную температуру. Хладоэлементы бывают объемом от 0,3 до 0,6 л.
Особенности конструкции и использования термоконтейнеров, хладоэлементов подробно изложены в утвержденных Госкомсанэпиднадзором России инструкциях, прилагаемых к этим изделиям.
Предприятие - изготовитель должно всегда иметь в своем распоряжении достаточный запас термоконтейнеров и хладоэлементов к ним, а также термоиндикаторов.
Предприятие - изготовитель должно отправлять вакцины таким образом, чтобы срок их годности позволял использование препаратов в течение, по крайней мере, 3-х месяцев с момента их поступления в аптечные склады и склады ЦГСЭН республиканского, краевого и областного уровней.
Отправка вакцин должна осуществляться через ближайшие аэропорт либо железнодорожную станцию, куда препараты, помещенные в термоконтейнер, должны доставляться крытым автотранспортом в условиях, исключающих механическое повреждение вакцин и воздействие на них неблагоприятных температурных факторов.
Продолжительность транспортировки вакцины от предприятия - изготовителя до 2-го уровня холодовой цепи не должна превышать 48 ч. Исходя из этого должен производиться выбор соответствующего транспортного средства. Запрещается отправка вакцины транспортом, прибытие которого в пункт назначения приходится на нерабочие дни, за исключением случаев, когда заказчик письменно гарантирует получение вакцины в такие дни.
Получатель вакцины должен быть заблаговременно (не менее чем за двое суток) информирован о прибытии препарата (телеграфом, телефоном или факсимильной связью). При этом информация должна содержать следующие данные: наименование вакцины, ее количество, номер серии, срок годности, номер авиарейса или поезда, дата отправки и получения, фамилия, должность и телефон отправителя.
Соответствующее транспортное агентство должно предоставлять транспортировке вакцин и других иммунобиологических препаратов наиболее благоприятные условия, включая сокращение сроков отправки и доставки, исключение воздействия неблагоприятных физических и термических факторов как в период нахождения препаратов в аэропорту (железнодорожной станции), в том числе и транзитом, так и в период их транспортирования.
В случае задержки отправления вакцины последнюю следует поместить в холодильные камеры или шкафы, если такие имеются в аэропорту (железнодорожной станции). В случае отсутствия таковых и при значительной задержке отправки (до 12 ч. и более) вакцины необходимо вернуть на предприятие - изготовитель по договоренности с последним.
Получатель вакцин должен заблаговременно согласовать с соответствующим транспортным агентством на месте процедуру получения груза непосредственно с борта самолета или вагона поезда.
Доставка полученной вакцины до аптечного склада 2-го уровня холодовой цепи осуществляется в максимально сжатые сроки.
Транспортировка осуществляется в строгом соответствии с сопроводительными документами.
17.12. Второй уровень холодовой цепи: республиканские, краевые и областные аптечные склады или склады ЦГСЭН.
При получении вакцины из аэропорта (железнодорожной станции) или доставке ее авторефрижераторным транспортом необходимо немедленно поместить груз в холодильную камеру, где произвести разгрузку термоконтейнеров. При этом необходимо проверить показатели соответствующих термоиндикаторов и внести в них необходимые записи, а также занести все регламентированные данные в журнал получения и отправки вакцин.
Освободившиеся термоконтейнеры обратно на предприятия не направляются. Они либо уничтожаются, либо используются на месте по усмотрению лица, ответственного за холодовую цепь на этом уровне.
На этом уровне холодовой цепи все вакцины хранятся в холодильной камере, холодильных шкафах или холодильниках при температуре 0-/+8 град. С. В случаях, когда возникает необходимость хранения препаратов более 3-х месяцев, живые вирусные вакцины рекомендуется хранить в пределах срока годности в замороженном состоянии, т.е. в морозильных камерах и морозильниках.
Лицо, ответственное за холодовую цепь на этом уровне, должно иметь заранее согласованный с нижестоящими структурами четкий план снабжения вакцинами соответствующих учреждений районного и городского уровня (3-й уровень холодовой цепи). На 2-м уровне холодовой цепи, т.е. на уровне аптечных складов республиканского, краевого и областного уровней и складов ЦГСЭН, транспортирование вакцин и других иммунобиологических препаратов также должно осуществляться в термоконтейнерах.
Аптечный склад или склад ЦГСЭН этого уровня должен всегда иметь достаточный запас замороженных хладоэлементов и резервный запас термоконтейнеров для транспортирования вакцин и других иммунобиологических препаратов в учреждения третьего уровня холодовой цепи.
Загрузка вакцины (вакцин) в термоконтейнер(ы) должна осуществляться в холодильной камере. В исключительных случаях загрузка может производиться при комнатной температуре, но в предельно сжатые сроки (не более 5-10 мин).
Лицо, ответственное за холодовую цепь на этом уровне, осуществляет контроль функционирования холодовой цепи на третьем уровне.
17.13. Третий уровень холодовой цепи: городские и районные (сельские и городские) аптечные склады или склады ЦГСЭН.
Все виды вакцин на этом уровне должны храниться при температуре в пределах 0-/+8 град. С.
Для хранения вакцин на этом уровне холодовой цепи аптечные склады должны располагать холодильниками или холодильными шкафами с достаточным полезным объемом, позволяющим хранить необходимое для обслуживаемой территории количество вакцин. Кроме того, для замораживания необходимого количества хладоэлементов необходим морозильник (морозильники).
Необходимо иметь достаточное количество термоконтейнеров для транспортирования необходимого количества вакцин из аптечного склада республики, края или области, а в случае необходимости и в некоторые учреждения, осуществляющие вакцинопрофилактику. В последнем случае использованный термоконтейнер должен быть возвращен вместе с хладоэлементами владельцу (городской или районный аптечный склад).
Транспортирование вакцин с высшего уровня холодовой цепи в городской или районный аптечный склад осуществляется авто- или другим доступным видом транспорта в термоконтейнерах.
Разгрузка поступившей или загрузка отправляемой вакцины в термоконтейнер (термоконтейнеры) осуществляется в максимально сжатые сроки, не превышающие 5-10 мин. При этом следует фиксировать и регистрировать показатели термоиндикаторов, если они используются.
Лицо, ответственное за холодовую цепь на этом уровне, должно вести строгий учет поступлений и отправлений вакцин, регулярно фиксировать показатели температурного режима на складе, показатели термоиндикаторов.
Лицо, ответственное за холодовую цепь на этом уровне, контролирует функционирование холодовой цепи в учреждениях, осуществляющих вакцинопрофилактику.
17.14. Четвертый уровень холодовой цепи: лечебно - профилактические учреждения, осуществляющие вакцинопрофилактику.
Все виды вакцин на этом уровне должны храниться в холодильной камере при температуре 0-/+8 град. С в строгом соответствии с инструкциями по применению препаратов.
Растворитель для вакцин должен храниться также в холодильнике, чтобы в случае подготовки вакцины к применению не вызвать повышение температуры последней. В морозильном отделении необходимо иметь запас замороженных хладоэлементов. Длительность хранения вакцины на этом уровне холодовой цепи не должна превышать 1 месяца.
На этом уровне холодовой цепи необходимо иметь холодильник (холодильники), предназначенный только для хранения вакцин и других иммунобиологических препаратов. Хранение в них иных препаратов или предметов не допускается. Тип холодильника определяется, исходя из полезного объема его холодильной камеры и количества необходимых вакцин для вакцинации населения обслуживаемой территории.
Учреждение должно иметь достаточное количество термоконтейнеров для транспортирования вакцин из городского или районного аптечного склада или складов ЦГСЭН, а также для проведения вакцинации на выезде. Объем термоконтейнеров зависит от объема проводимой данным учреждением работы по вакцинации населения соответствующей территории. Необходимо также иметь достаточное количество хладоэлементов. Транспортирование вакцин осуществляется авто- или другим видом транспорта. Разгрузка или загрузка термоконтейнеров должна осуществляться максимально быстро, не более 5-10 мин.
Лицо, ответственное за холодовую цепь на этом уровне, должно вести строгий учет поступления и расхода вакцин и других иммунобиологических препаратов, фиксировать показатели температурного режима хранения препаратов и показатели термоиндикаторов.
Документ прочитан: 26988 раз(а)
Задать вопрос юристу по регулированию фармацевтической и медицинской деятельности
Ваш заказ отправлен на рассмотрение
Заказ платной услуги
Ваш заказ отправлен на рассмотрение
государственноесанитарно-эпидемиологическое нормирование Российской Федерации
государственные санитарно-эпидемиологические правила
и нормативы
3.3.2. МЕДИЦИНСКИЕИММУНОБИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ
Условия транспортирования и хранения
медицинских иммунобиологических препаратов
Санитарно-эпидемиологические правила
СП 3.3.2.1248-03
Минздрав России
Москва 2003
1. Ра з работаны:Департ а ментом Госсанэпиднад з ора (Г.Ф. Лазик о ва);Федераль н ым центром госсанэпидна д зора Минздрава России (А.А. Ясинский, В.Н. Са д ов н ико в а, Е.А. К отова); Г ИСК им. Л.А.Тарасевича (Т.А. Бе кт емир ов ).
П ри подготовке настоящих санитарно-эпидемиологических правилучтены замечания и предложения специалистов центров Госсанэпиднадзора в г. Москве, Санкт-Петербурге, Республиках Карелии,Башкортостане, Хакасии, Алтайском, Ста в ропольскомкраях, Московской, Тульской, Ростовской, Воронежской, Калининградской,Нижегородской, Новгородской, Омской, Вологодской, Тюменской, Новосибирской,Челябинской, Кемеровской, Курганской областях, ГУП « Иммунопрепарат » (г. Уфа), АООТ « Биоме д» им. И. И. Мечникова(Московская область), НПО «Биомед» (г. Пермь), ГУП И ПВЭ им. М.П. Чумакова РАМН (Московская область), ГУМосковского предприятия по производству бактерийных препаратов (г. Москва),Ассоц и ации производителей медицинскихиммунобиологических препаратов « Иммуно г ен » (г. Москва), ООО « Термоко н т » (г. Москва).
2. Рекомендованы к утверждению Комиссией по государственномусанитарно-эпидемиологическому нормированию при Министерстве здравоохраненияРоссийской Федерации (протокол № 17 от 6 февраля 2003 г.).
3. Утверждены Главным государственным санитарным врачомРоссийской Федерации - Первым заместителем Министра здравоохранения РоссийскойФедерации Г.Г. О н и щ енко 20 марта 2003 г.
4. Введены в действие постановлением Главногогосударственного санитарного врача Российской Федерации от 20.03.03 № 22 с 30июня 2003 г.
5. Зарегистрированы в Министерстве юстиции РоссийскойФедерации (регистрационный номер 4410 от 11 апреля 2003 г.).
6. С момента введ е ния настоящих санитарно-эпидемиологических правил сч ит ать утратив ш ими силусанитарно-эпидемиологические правила «Условия транспортирования и хранениямедицинских иммунобиологических препаратов СП 3.3.2.02 8-9 5», утвержденные постановлением Госкомсанэ п и дн а д зора России № 6 от 24.05.95.
Федеральный законРоссийской Федерации
«О санитарно-эпидемиологическом благополучии населения»
№ 52-ФЗ от 30 марта 1999 г.
«Государственныесанитарно-эпидемиологические правила и нормативы (далее - санитарные правила) -нормативные правовые акты, устанавливающие санитарно-эпидемиологическиетребования (в том числе критерии безопасности и (или) безвредности факторовсреды обитания для человека, гигиенические и иные нормативы), несоблюдениекоторых создает угрозу жизни или здоровью человека, а также угрозувозникновения и распространения заболеваний» (статья 1).
«Натерритории Российской Федерации действуют федеральные санитарные правила,утвержденные и введенные в действие федеральным органом исполнительной власти,уполномоченным осуществлять государственный санитарно-эпидемиологический надзорв порядке, установленном Правительством Российской Федерации.
Соблюдениесанитарных правил является обязательным для граждан, индивидуальныхпредпринимателей и юридических лиц» (статья 39).
«Занарушение санитарного законодательства устанавливается дисциплинарная,административная и уголовная ответственность» (статья 55).

Министерство здравоохранения Российской Федерации
ГЛАВНЫЙГОСУДАРСТВЕННЫЙ САНИТАРНЫЙ ВРАЧ
РОССИЙСКОЙ ФЕДЕРАЦИИ
О введении в действиесанитарно-эпидемиологических правил
На основанииФедерального закона «О санитарно-эпидемиологическом благополучии населения» от30 марта 1999 г. № 52-ФЗ (Собрание законодательства РоссийскойФедерации, 19 99, № 14. ст. 1650) и Положения о государственномсанитарно-эпидемиологическом нормировании, утвержденного постановлениемПравительства Российской Федерации от 24 июля 2000 г. № 554 (Собраниезаконодательства Российской Федерации, 2000, № 3 1, ст. 3295)
Ввестив действие с 30 июня 2003 г. санитарно-эпидемиологические правила «Условиятранспортирования и хранения медицинских иммунобиологических препаратов. СП3.3.2.1248-03», утвержденные Главным государственным санитарным врачомРоссийской Федерации 20 марта 2003 г.

Министерство здравоохранения Российской Федерации
ГЛАВНЫЙГОСУДАРСТВЕННЫЙ САНИТАРНЫЙ ВРАЧ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Об отмене СП 3.3.2.028-95
На основанииФедерального закона «О санитарно-эпидемиологическом благополучии населения» от30 марта 1999 г. № 52-ФЗ ( Собрание законодательства РоссийскойФедерации, 19 99, № 14. ст. 1650) и Положения о государственномсанитарно-эпидемиологическом нормировании, утвержденного постановлениемПравительства Российской Федерации от 24 июля 2000 г. № 554 (Собраниезаконодательства Российской Федерации, 2000, № 3 1, ст. 3295)
1. С момента введения в действиесанитарно-эпидемиологических правил «Условия транспортирования и хранениямедицинских иммунобиологических препаратов. СП 3.3.2.1248-03», с 30.06.03считать утратившими силу санитарно-эпидемиологические правила «Условиятранспортирования и хранения медицинских иммунобиологических препаратов СП3.3.2.02 8-9 5», утвержденные постановлениемГоскомсанэ п иднадзора России № 6 от 24.05.95.
Условиятранспортированияи хранения медицинских иммунобиологич ес к их препаратов
1. 1. Настоящие санитарно-эпидемиологическиеправила (далее - санитарные правила ) разработаны в соответствии сФедеральным законом «О санитарно-эпидемиологическом благополучии населения» от30 марта 1999 г. № 52-ФЗ » (Собрание законодательства РоссийскойФедерации, 1999, № 14, ст. 1650), Положением о государственномсанитарно-эпидемиологическом нормировании, утвержденным постановлениемПравительства Российской Федерации от 24 июля 2000 г. № 554 (Собраниезаконодательства Российской Федерации, 2000, № 31, ст. 3295).
1.2. Санитарные правила устанавливают общие требования ккомплексу организационных и технических мероприятий. обеспечивающих сохранность качествамедицинских иммунобиологических препаратов (лекарственные средства, предназначенныедля иммунопрофилактики, иммунотерапии и диагностики болезней и аллергическихсостояний).
1.3. Санитарные правила устанавливают порядоктранспортирования и хранения медицинских иммунобиологических препаратов отмомента их изготовления до использования в организациях здравоохранения.
1.4. Санитарные правила предназначены для юридических лиц,индивидуальных предпринимателей, независимо от ведомственной принадлежности иформ собственности, осуществляющих транспортирование и хранение медицинских иммунобиологическихпрепаратов.
Постановлением Главного государственногосанитарного врача РФ от 18 февраля 2008 г. N 9 п. 1.5. настоящихСанитарно-эпидемиологических правил изложен в новой редакции. Изменение вступаетв действие с 1 июня 2008 г.
1.5. Контроль за выполнениемнастоящих санитарных правил и методическое руководство по осуществлениюкомплекса организационно-технических мероприятий, обеспечивающих оптимальныетемпературные условия при транспортировании и хранении медицинскихиммунобиологических препаратов ("холодовая цепь"), проводят органы,осуществляющие государственный санитарно-эпидемиологический надзор.
2 .1. Для обеспечения высокого качествамедицинских иммунобиологических препаратов (М ИБП ), безопасности и эффективности их применения создают систему « холодовой цепи».
2.2. На всех уровнях «холодовой цепи» должны работатьспециально обученные специалисты с определением служебных обязанностей всоответствии с занимаемой ими должностью и объемом работы.
2.3. Настоящие санитарные правила устанавливают общиетребования ко всем группам медицинских иммунобиологических препаратов.Особенности транспортирования и хранения медицинских иммунобиологическихпрепаратов определяются также в докумен т ах на данные препараты.
Система«холодовой цепи» состоит из 4-х уровней.
3 .1. Первый уровень организуется оторганизаций-изготовителей медицинских иммунобиологических препаратов доаптечных складов в субъектах Российской Федерации.
3.2. Второй уровень организуется от аптечных складов искладов центров Госсанэпиднадзора в субъектах Российской Федерации до городскихи районных (городских и сельских) аптечных складов, а также складов организацийздравоохранения.
3.3. Третий уровень организуется отгородских и районных (городских и сельских) аптечных складов долечебно-профилактических организаций (участковых боль н иц, амбулаторий, поликлиник, родильныхдомов, фельдшерско-акушерских пунктов и др.).
3.4. Четвертый уровень организуетсялечебно-профилактическими организациями (участковыми больницами, амбулаториями,поликлиниками, родильными домами, фельдшерско-акушерскими пунктами и др.).
4. 1. При транспортировании и хранении медицинскихиммунобиологических препаратов соблюдаются условия, обеспечиваю щ ие сохранность их исходного качества; обеспечивается за щ ита препарата от воздействия температуры окружающей среды,от повреждения упаковок, расплескивания и т.д.
Постановлением Главного государственногосанитарного врача РФ от 18 февраля 2008 г. N 9 п. 4.2. настоящихСанитарно-эпидемиологических правил изложен в новой редакции. Изменение вступаетв действие с 1 июня 2008 г.
4.2. Транспортирование ихранение медицинских иммунобиологических препаратов в системе "холодовойцепи" осуществляют при следующих температурных условиях:
транспортирование и хранениемедицинских иммунобиологических препаратов - при температуре 5 ± 3°С (впределах от 2 до 8°С);
хранение живой вакциныпротив полиомиелита - при температуре минус 20°С и ниже, при транспортированииуказанной вакцины в температурном режиме 5 ± 3°С (в пределах от 2 до 8°С)допускается последующее повторное ее замораживание до минус 20°С;
хранение вакцины желтойлихорадки - при температуре минус 20°С и ниже, транспортирование производят притемпературе 5 ± 3°С (в пределах от 2 до 8°С).
Постановлением Главного государственногосанитарного врача РФ от 18 февраля 2008 г. N 9 п. 4.3. настоящихСанитарно-эпидемиологических правил изложен в новой редакции. Изменение вступаетв действие с 1 июня 2008 г.
4.3. Не допускаетсязамораживание адсорбированных препаратов (коклюшно-дифтерийно-столбнячнойвакцины, дифтерийно-столбнячного анатоксина, вакцины против гепатита А, вакциныпротив гепатита В, инактивированной полиомиелитной вакцины и др.), а такжерастворителей вакцин при транспортировании и хранении.
4.4. При определении режима транспортирования и хранениякаждого отдельного медицинского иммунобиологического препарата руководствуютсядокументами на данный препарат.
ПостановлениемГлавного государственного санитарного врача РФ от 18 февраля 2008 г. N 9 глава IV настоящихСанитарно-эпидемиологических правил дополнена пунктом 4.5. Изменение вступает вдействие с 1 июня 2008 г.
4.5. На первом уровне "холодовой цепи"допускается хранение коревой, краснушной, паротитной вакцины и соответствующихассоциированных вакцин, выпускаемых отдельно от растворителя, при температуреминус 20°С.
5.1. Холодильное оборудование, предназначенное длятранспортирования и хранения медицинских иммунобиологических препаратов, должнообеспечивать:
· установленный температурный режим в течение всего временитранспортирования и хранения;
· достаточный объем для размещения максимального запаса медицинскихиммунобиологических препаратов, который может поступить на данный уровень«холодовой цепи»;
· замораживание достаточного количества хладоэлементов, используемыхв комплекте с термоконтейнерами.
5.2. В системе «холодовой цепи» используют следующее оборудование:
· холодильные комнаты (камеры) или большие холодильники-прилавки(открывающиеся сверху);
· морозильные камеры или морозильные прилавки (фризеры);
5.3. Холодильные комнаты (камеры) используют на всех уровнях«холодовой цепи» для хранения и упаковки медицинских иммунобиологическихпрепаратов. Холодильные комнаты (камеры) оборудуют стеллажами, маркированнымидля каждого вида медицинских иммунобиологических препаратов. Загрузкахолодильных камер должна обеспечивать свободную циркуляцию воздуха по всемуобъему. Контроль температурного режима холодильных комнат (камер) осуществляютс помощью термографов или терморегистраторов.
5.4. Морозильные камеры используют для медицинскихиммунобиологических препаратов, которые согласно инструкции по их применениюдолжны храниться в замороженном состоянии. а также для замораживания и хранения хладоэлементов,используемых в термоконтейнерах. Непрерывный контроль температурного режимаморозильных камер осуществляют с помощью термографов или терморегистраторов.
5.5. Морозильники используют для замораживания хла д оэлементов в соответствии с инструкцией поприменению термоконтейнеров и хла д оэлементов.
5.6. Бытовые холодильники используют для хранения медицинскихиммунобиологических препаратов и для замораживания хладоэлементовпреимущественно на 3-м и 4 - муровнях « холодовой цепи».
5.7. Термоконтейнеры, являющиеся изделиями медицинскогоназначения, разрешается применять для хранения и транспортирования медицинскихиммунобиологических препаратов после проведения государственной регистрации вустановленном порядке.
Термоконтейнерыемкостью свыше 10 дм 3 должны обеспечивать температурный режим хранения итранспортирования от 2 до 8 °С не менее 48 ч при постоянном воздействиитемпературы окружающей среды 43 ° С и от 8 до 2 °С не менее 10 ч при постоянном воздействии температурыокружающей среды -30 °С.
Термоконтейнерыемкостью менее 10 дм 3 должныобеспечивать температурный режим хранения и транспортирования медицинскихиммунобиологических препаратов от 2 до 8 ° С неменее 24 ч при постоянном воздействии температуры окружающей среды 43 ° С и от 8 до 2 ° С не менее10 ч при постоянном воздействии температуры окружающей среды -20 °С.
Внутренниеповерхности термоконтейнеров должны быть покрыты материалами, позволяющимиперед повторным использованием производить дезинфекцию в соответствии спаспортом и инструкцией по применению термоконтейнеров.
Термоконтейнерыдолжны быть укомплектованы паспортом, инструкцией по применению и необходимымколичеством хладоэлементов.
Постановлением Главного государственногосанитарного врача РФ от 18 февраля 2008 г. N 9 п. 5.8. настоящихСанитарно-эпидемиологических правил изложен в новой редакции. Изменение вступаетв действие с 1 июня 2008 г.
5.8. Медицинскаясумка-холодильник (малый термоконтейнер) должна обеспечивать температурныйрежим 5 ± 3°С (в пределах от 2 до 8°С) при температуре окружающей среды 43°С неменее 24 ч. Внутренние поверхности сумки должны быть покрыты специальнымиматериалами, позволяющими проводить дезинфекцию.
5.9. Использование хладоэлементов осуществляют в соответствиис требованиями, изложенными в прилагаемом паспорте.
5.10. Термоиндикаторы и терморегистраторы (термографы),являющиеся изделиями медицинского назначения, разрешается применять вмедицинских целях после проведения государственной регистрации в установленномпорядке.
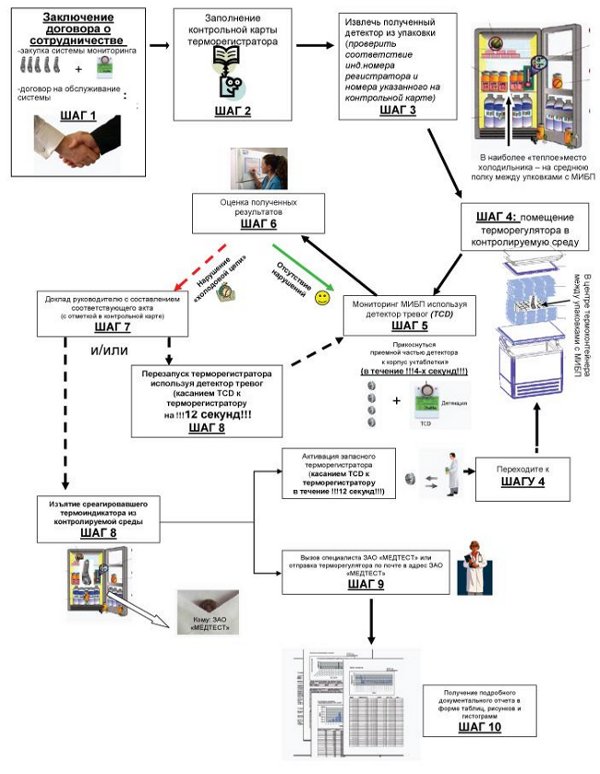
Термоиндикаторыи терморегистраторы должны обеспечивать контроль соблюдения температурногорежима от момента закладки медицинских иммунобиологических препаратов вупаковочную тару до получения медицинских иммунобиологических препаратовпользователями.
Ктермоиндикаторам одноразового использования должны прилагаться контрольныекарточки индикатора (ККИ), заполняемые с момента закладки медицинскихиммунобиологических препаратов в упаковочную тару до получения медицинских иммунобиологическихпрепаратов пользователями.
5. 11. Специальные авторефрижераторы используют длятранспортирования медицинских иммунобиологических препаратов на всех уровнях « холодовой цепи», а также они могут использоватьсяв качестве холодильных или морозильных камер для временного хранениямедицинских иммунобиологических препаратов. Специальные авторефрижераторыоборудуют приборами (термографы и др.), позволяющими получать документальноеподтверждение соблюдения температурного режима во время транспортированиямедицинских иммунобиологических препаратов. Специальные авторефрижераторы иконтрольно-измерительные (регистрационные) приборы, используемые для измерениятемпературного режима, подлежат контролю в установленном порядке.Дезинфекционную обработку кузовов специальных авторефрижераторов проводяторганизации в соответствии с инструкцией.
6 .1. На всех уровнях «холодовой цепи» проводят регистрациюпоступления и отправления медицинских иммунобиологических препаратов ворганизации с указанием наименования препарата, его количества и серии,контрольного номера, срока годности, даты поступления (отправления), показаниятермоиндикаторов (терморегистраторов), ф. и. о. ответственного работника,осуществляющего регистрацию. Сотрудник, осуществляющий регистрацию, долженпройти соответствующую подготовку по вопросам соблюдения условий хранения итранспортирования медицинских иммунобиологических препаратов и работе сприборами, регистрирующими изменения температурного режима (термоиндикаторы итерморегистраторы).
Прирегистрации поступления препарата указывают поставщика и условия транспортирования.
Ежедневно2 раза в день в специальном журнале отмечают показания термоиндикаторов илитерморегистраторов холодильных (морозильных) камер, в которых хранятмедицинские иммунобиологические препараты.
6.2. В организациях 1-го, 2-го и 3-го уровней « холодовой цепи» определяют порядокобеспечения температурного режима хранения и транспортирования медицинскихиммунобиологических препаратов и обязанности должностных лиц, ответственных заобеспечение «холодовой цепи» на данном уровне.
6.3. Транспортирование медицинских иммунобиологическихпрепаратов всеми видами транспорта, кроме авторефрижераторного, осуществляют вмедицинских термоконтейнерах, имеющих свидетельства о государственнойрегистрации установленного образца. Каждую партию медицинских иммунобиологическихпрепаратов, отправляемых в один адрес, обеспечивают термоиндикаторамидопустимых верхних и нижних границ температурного диапазона илитерморегистратором.
6.4. При транспортировании медицинских иммунобиологическихпрепаратов авторефрижераторным транспортом допускается в качестве транспортнойтары использовать коробки из фанеры, гофра-картона, полистирола и другихматериалов. Способ размещения коробов в кузове специального авторефрижераторадолжен обеспечивать свободную циркуляцию воздуха и сохранность медицинскихиммунобиологических препаратов. Для контроля температурного режима используютпоказания устройства для непрерывного контроля параметров температурного режимав изотермическом кузове специального авторефрижератора.
6.5. При документальном подтверждении нарушения температурногорежима при транспортировании ответственный работник, осуществляющий прием ирегистрацию соблюдения требований «холодовой цепи» на всех уровнях, обязандоложить об этом руководителю и составить соответствующий акт. Решение оботказе получения медицинских иммунобиологических препаратов и направлении их наповторную проверку качества принимает руководитель организации.
6.6. Требования к организации транспортирования и хранениямедицинских иммунобиологических препаратов на 1-м уровне «холодовой цепи».
6.6.1. На 1-м уровне контроль качества произведенных медицинскихиммунобиологических препаратов осуществляют отделы биологического и тех н ологического контроля ( О БТК) организаций-изготовителей и (или) национальный органконтроля. Медицинские иммунобиологические препараты на 1-м уровне хранятсогласно инструкции по их применению в холодильных или морозильных камерах.Упаковку медицинских иммунобиологических препаратов в термоконтейнерыосуществляют в холодильных комнатах (камерах).
6.6.2. Перед отправлением медицинских иммунобиологическихпрепаратов потребителям в термоконтейнеры закладывают хладоэлеме н т ы. паспорти инструкцию по применению термоконтейнера. Для обеспечения необходимоготемпературного режима количество и тип заклады в аемыхв термоконтейнеры хла д оэлементов должнысоответствовать требованиям документов на используемые термоконтейнеры ихладоэлемент ы. Термоконтейнер, в которомнаходятся сопроводительные документы, отмечают.
6.6.3. В один из термоконтейнеров партии медицинскихиммунобиологических препаратов, транспортируемой в адрес получателя. помещают в соответствии с техническойдокументацией терморегистратор или термоиндикатор, позволяющие обеспечитьконтроль соблюдения и продолжительность нарушения температурного режима.
6.6.4. Организация-изготовитель медицинских иммунобиологическихпрепаратов должна иметь достаточный запас термоконтейнеров, термоиндикаторов(терморегистраторов) и хладоэлементов для выполнения мероприятий в чрезвычайныхситуациях.
6.6.5. Транспортирование медицинских иммунобиологическихпрепаратов до аэропортов и железнодорожных станций осуществляют специальнымиавторефрижераторами или в термоконтейнерах крытым автотранспортом. Призадерживании отправления медицинских иммунобиологических препаратов продолжительностьюболее 12 ч, препараты возвращают в организацию-изготовитель.
6.6.6. Продолжительность транспортирования термоконтейнеров смедицинскими иммунобиологическими препаратами не должна превышать времени, втечение которого используемые термоконтейнеры гарантируют поддержание в нихтребуемого температурного режима. Для более длительного транспортированиямедицинских иммунобиологических препаратов используют специальныеавторефрижераторы.
6.6.7. Сроки, время, пункты отправления и получения, условиятранспортирования согласовывают заблаговременно с целью сохранения качества исроков годности медицинских иммунобиологических препаратов.
6.6.8. Транспортирование осуществляют в соответствии ссопроводительными документами, требованиями упаковки и маркировки грузов.
6 .7. Требования к организации транспортирования и хранениямедицинских иммунобиологических препаратов на 2-м уровне « холодовой цепи».
6.7. 1. При получении медицинскихиммунобиологических препаратов из аэропорта (железнодорожной станции) или придоставке их авторефрижераторным транспортом, груз немедленно помещают вхолодильную комнату (камеру). При этом проверяют показатели термоиндикаторов(терморегистраторов) и расписываются в приеме медицинских иммунобиологическихпрепаратов.
6.7.2. Освободившиеся термоконтейнеры многоразовогоиспользования, по согласованию с поставщиком медицинских иммунобиологическихпрепаратов, возвращают обратно или после проведения санитарной обработки, всоответствии с прилагаемой технической документацией на термоконтейнер,используют на 2-3-4 уровнях.
6.7.3. На 2-м уровне « холодовой цепи» медицинские иммунобиологические препаратыхранят в холодильных камерах при температуре, соответствующей требованиямнормативных документов на препараты. Должностное лицо, ответственное за « холодову ю цепь» на этомуровне, должно иметь заранее согласованный график поставки медицинскихиммунобиологических препаратов на 3-й уровень и контролировать сроки годностипрепаратов, не допуская отгрузки медицинских иммунобиологических препаратов сосроком годности менее 1 месяца.
Длявыполнения плана экстренных мероприятий по обеспечению «холодовой цепи» вчрезвычайных ситуациях 2-й уровень должен иметь достаточный запас резервныхтермоконтейнеров, термоиндикаторов и замороженных хладоэлементов.
6.7.4. Укладку медицинских иммунобиологических препаратов втермоконтейнеры, которые направляются на 3-й уровень, осуществляют вхолодильной комнате (камере). В исключительных случаях укладка медицинскихиммунобиологических препаратов в термоконтейнеры может производиться прикомнатной температуре в срок до 10 мин.
6.7.5. Лицо, ответственное за « холодов у юцепь» на 2-м уровне, осуществляет контроль за условиями отпуска длятранспортирования медицинских иммунобиологических препаратов на 3-й, 4-й уровнипри соблюдении температурного режима.
6.8. Требования к организации хранения и транспортированиямедицинских иммунобиологических препаратов на 3-м уровне « холодовой цепи».
Постановлением Главного государственногосанитарного врача РФ от 18 февраля 2008 г. N 9 п. 6.8.1. настоящихСанитарно-эпидемиологических правил изложен в новой редакции. Изменение вступаетв действие с 1 июня 2008 г.
6.8.1. Все виды медицинскихиммунобиологических препаратов на 3-м уровне хранят при температуре 5 ± 3°С (впределах от 2 до 8°С) в холодильниках, холодильных шкафах или холодильныхкамерах. Для замораживания необходимого количества хладоэлементов, в том числедля чрезвычайных ситуаций, используют морозильники. На 3-м уровне должно бытьдостаточное количество резервных термоконтейнеров для транспортированиямедицинских иммунобиологических препаратов в учреждениях, осуществляющихвакцинопрофилактику.
6.8.2. Транспортирование медицинских иммунобиологическихпрепаратов на 3-й уровень осуществляют в термоконтейнерах. Выгрузку поступившихмедицинских иммунобиологических препаратов и их отгрузку на 4-й уровеньосуществля ю тв максимально короткие сроки.
Должностноелицо, ответственное за «холодовую цепь» на 3-м уровне, ведет строгий учетпоступлений и отправлений медицинских иммунобиологических препаратов, регулярноконтролирует показания термоиндикаторов (терморегистраторов), осуществляетконтроль за условиями отпуска и транспортирования медицинскихиммунобиологических препаратов на 4-й уровень при соблюдении температурного режима.
6.9. Требования к организации хранения и транспортированиямедицинских иммунобиологических препаратов на 4-м уровне « холодовой цепи».
Постановлением Главного государственногосанитарного врача РФ от 18 февраля 2008 г. N 9 п. 6.9.1. настоящихСанитарно-эпидемиологических правил изложен в новой редакции. Изменение вступаетв действие с 1 июня 2008 г.
6.9.1. Все виды медицинскихиммунобиологических препаратов на 4-м уровне хранят в холодильных шкафах или вбытовых холодильниках при температуре 5 ± 3°С (в пределах от 2 до 8°С),термометры размещают на верхней и нижней полках холодильника.
6.9.2. На 4-м уровне создается достаточный резерв холодильныхсумок и хладоэле м е нт ов для доставки медицинских иммунобиологических препаратовк местам проведения вакцинации. Загрузку или разгрузку термоконтейнеров(холодильных сумок) осуществляют в срок до 10 мин.
6.9.3. Должностное лицо, ответственное за « холодовую цепь» на 4-м уровне, ведет учетпоступления и расхода медицинских иммунобиологических препаратов, фиксируетпоказания т ермоиндикаторов(терморегистраторов), используемых для контроля температурного режима.
7. 1. Организацию комплексаорганизационно-технических мероприятий, создающих оптимальные температурныеусловия при транспортировании и хранении медицинских иммунобиологическихпрепаратов на 1-м уровне « холодовой цепи»,обеспечивают руководители организаций-изготовителей медицинскихиммунобиологических препаратов.
7.2. Организацию комплекса мероприятий, создающих оптимальныетемпературные условия при транспортировании и хранении медицинскихиммунобиологических препаратов на 2-м уровне «холодовой цепи», обеспечиваютруководители аптечных складов субъектов Российской Федерации, а такжеорганизаций, осуществляющих хранение и транспортирование медицинских имму н обиологических препаратов.
7.3. Организацию комплекса мероприятий, создающих оптимальныетемпературные условия при транспортировании и хранении медицинскихиммунобиологических препаратов на 3-м уровне «холодовой цепи», обеспечиваютруководители городских и районных (городских и сельских) аптечных складов, атакже организаций, осуществляющих транспортирование и хранение медицинскихиммунобиологических препаратов.
7.4. Организацию комплекса мероприятий, создающих оптимальныетемпературные условия при т ранспортированиии хранении медицинских иммунобиологических препаратов на 4-м уровне «холодовойцепи», обеспечивают руководители лечебно-профилактических организаций.
План э кстренных мероприятий по поддержанию «холодовой цепи» вчрезвычайных ситуациях должен предусматривать весь комплекс мероприятий привозникновении пожара и стихийных бедствий, при полном или локальном отключениипромышленной сети, неисправностей холодильного оборудования.
Планэкстренных мероприятий должен включать в себя следующие документы:
· схему размещения холодильных (морозильных) камер и холодильногооборудования на территории предприятия (учреждения), задействованных для размещениямедицинских иммунобиологических препаратов в повседневном режиме;
· схему размещения резервных холодильных (морозильных) камер,холодильного оборудования и термоконтейнеров, используемых только вчрезвычайных ситуациях с расчетом их оптимальной потребности;
· схему переключения холодильного оборудования на резервные иавтономные источники питания;
· расчет потребности холодильного (морозильного) оборудования итермоконтейнеров для обеспечения сохранности изготовленных медицинскихиммунобиологических препаратов;
· состав аварийно-восстановительных групп;
· должностные обязанности лиц по восстановлению работоспособностихолодильного оборудования и энергоснабжения;
· должностные обязанности лиц по обеспечению сохранностииммунобиологических препаратов в чрезвычайных ситуациях;
· порядок обеспечения сохранности медицинских иммунобиологическихпрепаратов во время их транспортирования по прямым и кольцевым маршрутам.
Примечание. С учетом специфики производства и территориального размещенияпредприятий по производству медицинских иммунобиологических препаратов,содержание плана может быть расширено.
1. Федеральный закон от 17.09.98 № 1 57-ФЗ «Об иммунопрофилактике инфекционныхболезней».
2. Федеральный закон от 22.06.98 № 86-ФЗ «О лекарственныхсредствах».
3. Постановление Правительства Российской Федерации от 24июля 2000 г. № 554 «Об утверждении Положения о государственнойсанитарно-эпидемиологической службе Российской Федерации и Положения огосударственном санитарно-эпидемиологическом нормировании».
4. Приказ Министерства здравоохранения Российской Федерацииот 10.05.00 № 15 6«О разрешении на применение в медицинских целях изделий медицинского назначенияи медицинской техники отечественного и зарубежного производства в РоссийскойФедерации».
5. Санитарные правила СП 3.3.2.015-94 «Производство и контроль медицинских иммунобиологическихпрепаратов для обеспечения их качества», утвержденные постановлениемГоскомсанэпиднадзора России от 12.08.94.