








 Рейтинг: 4.1/5.0 (1834 проголосовавших)
Рейтинг: 4.1/5.0 (1834 проголосовавших)Категория: Бланки/Образцы
"Фармацевтическое обозрение", 2002, N 9
ГОСУДАРСТВЕННЫЕ СТАНДАРТНЫЕ ОБРАЗЦЫ
Фармакопейный анализ лекарственных средств включает в себя оценку качества по множеству показателей. В частности, устанавливается подлинность лекарственного средства - проводится его идентификация, анализируется чистота - оценивается содержание различных органических и неорганических примесей и проводится количественное определение - устанавливается содержание действующего вещества. Первоначально для проведения такого анализа применяли исключительно химические методы: реакции подлинности, реакции на содержание примесей и титрование при количественном определении (метод, также основанный на химическом взаимодействии).
Со временем повысился не только уровень технического развития фармацевтической отрасли. Параллельно изменились и требования к качеству лекарственных средств. А в настоящее время появились дополнительные проблемы, связанные с оборотом лекарств. Особенно остро встал вопрос фальсификации - подделки лекарственных препаратов, что, в свою очередь, ужесточает требования к фармакопейному анализу.
В связи с вышесказанным в последние годы наметилась тенденция к переходу на расширенное использование физических и физико-химических методов анализа. В частности, широко применяются спектральные методы: инфракрасная (ИК) и ультрафиолетовая (УФ) спектрофотометрия, спектроскопия ядерного магнитного резонанса (ЯМР) и др. Активно используются хроматографические методы: высокоэффективная жидкостная хроматография (ВЭЖХ), газожидкостная хроматография (ГЖХ), тонкослойная хроматография (ТСХ), электрофорез и др. Речь, безусловно, не идет о полном исключении химического анализа лекарственных препаратов и субстанций. Тем не менее, обзор зарубежных фармакопейных статей позволяет сделать заключение, что для установления подлинности, анализа чистоты и количественного определения ведущие фармакопеи преимущественно используют именно физические и физико-химические методы.
При анализе такими методами оцениваются различные нехимические свойства лекарственных веществ, которые можно было бы теоретически один раз описать и затем просто сличать полученный в опыте результат с имеющимися данными. Однако условия эксперимента (температура, влажность, давление) в каждом центре контроля качества свои, и оборудование тоже свое - определенного производителя и определенной степени износа. И анализы также делают разные люди. В связи с этим хроматограмма или спектр, полученные для одного и того же вещества в одной лаборатории одним человеком, но в разные дни, будут различаться. Соответственно, на основе таких вариабельных данных сложно сделать заключение о качестве лекарственного препарата.
Выход из данной ситуации был найден уже давно. При использовании физико-химических (и биологических) методов анализа необходимо применять стандартные образцы. Они представляют собой, грубо говоря, точно охарактеризованные вещества (лекарственные или их примеси), которые подвергаются при контроле качества тому же анализу, что и испытуемый препарат. И, например, одинаковое положение пиков или пятен на хроматограмме или совпадение спектров стандартного и испытуемого веществ свидетельствует в пользу подлинности последнего.
На актуальность данной проблемы указывают также следующие цифры. В Британской фармакопее насчитывается около 500 стандартных образцов, в Фармакопее США - около 1300. Если же принять во внимание данные ВОЗ, которая ежегодно публикует каталог стандартных образцов, выпускаемых как отдельными фармакопеями, так и специально созданными для этой цели центрами, то окажется, что всего в мире циркулирует свыше 3700 стандартных образцов лекарственных веществ и их примесей. К этим данным можно относиться по-разному. Но если учесть, что разработка и производство стандартных образцов - процессы трудоемкие и дорогостоящие, требующие более углубленного и рутинного подхода по сравнению с производством фармацевтических субстанций и препаратов, и что, соответственно, стоимость коммерчески распространяемых образцов достаточно высока, а количество этих субстанций в одной упаковке невелико (обычно 50-200 мг), то указанные выше цифры следует признать внушительными. Говоря образно, стандартные образцы - это высший пилотаж фармакопейного анализа.
В Российской Федерации зарегистрировано около 170 стандартных образцов отечественных производителей. Однако большинство из них в настоящее время либо не доступно вообще, либо производится в недостаточных количествах.
Принимая во внимание вышесказанное, а также учитывая планируемый выпуск очередного издания Государственной фармакопеи РФ, специалистами Фармакопейного государственного комитета Минздрава РФ были подготовлены проекты следующих документов.
1. Положение о Государственных стандартных образцах, применяемых для контроля качества лекарственных средств.
2. Общая фармакопейная статья (ОФС) "Государственные стандартные образцы" (вместо статьи ГФ XI, вып. 2 "Стандартные образцы").
3. Общие рекомендации по разработке, производству и распределению Государственных стандартных образцов, применяемых для контроля качества лекарственных средств.
Данные документы разработаны в соответствии с рекомендациями ВОЗ и с учетом требований ведущих зарубежных фармакопей. Эти документы не распространяются на стандартные образцы медицинских иммунобиологических препаратов, препаратов и компонентов крови и радиофармацевтических препаратов.
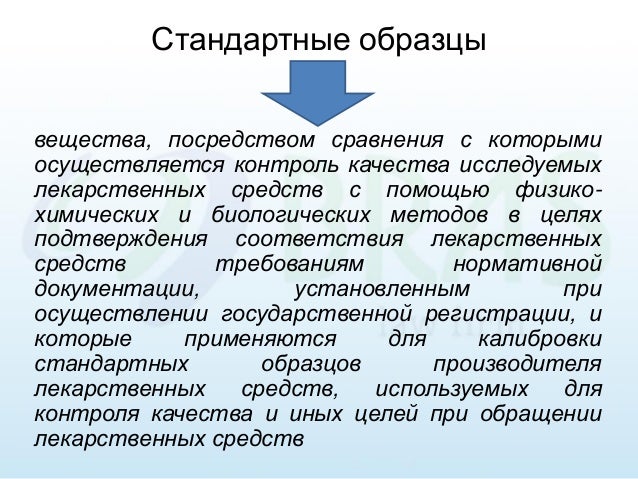
ОПРЕДЕЛЕНИЕ: Государственные стандартные образцы (ГСО), применяемые для контроля качества лекарственных средств - это вещества, с которыми сравнивают испытуемые лекарственные средства при проведении их анализа с использованием физико-химических и биологических методов.
Основные положения предлагаемой системы ГСО
1. Цель использования ГСО в фармакопейном анализе - получение точных (правильных) и воспроизводимых результатов.
Поскольку анализ исследуемого вещества и соответствующие измерения с применением ГСО осуществляются в идентичных условиях, устраняются ошибки, связанные с различием в показаниях отдельных приборов и с влиянием внешних условий (температура, давление и др.), зависящих от конкретной лаборатории. Этот факт заставляет использовать стандартные образцы вместо абсолютных значений параметров или ранее вычисленных коэффициентов.
2. Применение ГСО для установления подлинности, анализа чистоты и количественного определения обусловлено соответствующими указаниями в фармакопейной статье (ФС) или фармакопейной статье предприятия (ФСП) на лекарственное средство. Недопустимо использование для этих целей любых других химических соединений, не имеющих статуса ГСО.
Данное положение является чрезвычайно важным. В Государственной фармакопее СССР XI издания выделяются три вида стандартных образцов: ГСО, РСО (рабочие стандартные образцы) и СОВС (стандартные образцы веществ-свидетелей). ГСО могут применяться как для анализа лекарственных веществ, так и для анализа лекарственных препаратов (лекарственных форм). РСО, являющиеся рядовыми фармацевтическими субстанциями, отвечающими требованиям соответствующей нормативной документации (НД), могут использоваться только для анализа готовых лекарственных форм. То есть нельзя анализировать соответствие качества субстанции требованиям НД с использованием субстанции, соответствующей тем же требованиям.
Такой же подход в отношении РСО применяется в ряде европейских стран, он же рекомендуется ВОЗ. Однако рекомендации ВОЗ направлены как на развитые страны, так и на развивающиеся. Обычно при этом приходится поступаться некоторыми принципами. Конечно, использование рабочих стандартов экономически более выгодно и для производителя лекарств, и для того, кто эти лекарства будет анализировать. Однако, во-первых, это не соответствует идеологии стандартных образцов. А во-вторых, экономически более выгодно было бы вообще ничего не анализировать.
Если взглянуть за Атлантический океан, то мы увидим, что в США РСО не применяются. Если в ФС требуется использовать стандартный образец, то это должен быть стандарт Фармакопеи США. Такой жесткий подход соответствует принципам современного фармакопейного анализа. Именно такую модель предлагается взять за основу, принимая во внимание, что Государственная фармакопея должна учитывать, в первую очередь, качество лекарственных средств и интересы потребителя.
Выделение стандартов в отдельную группу СОВС также нецелесообразно. Данные стандарты будут являться ГСО, имеющими соответствующую область применения.
Для того чтобы смягчить переход на такую модель стандартных образцов, в ОФС "Государственные стандартные образцы" включено следующее примечание: "Применение в качестве стандартных образцов рабочих стандартных образцов (РСО) и стандартных образцов веществ-свидетелей (СОВС) согласно ГФ XI (выпуск II, стр. 60) допускается на период действия утвержденной нормативной документации (фармакопейные статьи и фармакопейные статьи предприятий). При пересмотре нормативной документации следует руководствоваться настоящей фармакопейной статьей, Положением о Государственных стандартных образцах, применяемых для контроля качества лекарственных средств и Общими рекомендациями по разработке, производству и распределению Государственных стандартных образцов, применяемых для контроля качества лекарственных средств".
3. ГСО не могут использоваться в качестве лекарственных средств.
Несмотря на то, что процедура регистрации ГСО напоминает таковую для лекарственных препаратов и субстанций, нельзя применять стандартные образцы для лечения, профилактики и диагностики.
4. ФС на ГСО является Государственным стандартом качества, рассматривается Фармакопейным государственным комитетом Минздрава РФ и утверждается в установленном порядке.
5. Каждый ГСО имеет конкретную область применения, которая определяет требования к его качеству. Ответственность за использование ГСО в других целях несет потребитель ГСО.
Это также немаловажный момент. Подход к качеству стандартного образца такой же, как и для лекарственных средств: уровень качества зависит от области и способа применения. То есть, если, например, лекарственное вещество предназначено для изготовления нестерильного лекарственного препарата, то требование стерильности нецелесообразно применять и к самому веществу.
Предполагается назначить каждой области применения ГСО соответствующий код, который будет указываться на упаковке ГСО. Такая же система кодов применяется Европейским департаментом по контролю качества лекарственных средств при Совете Европы (European Department for the Quality of Medicines, EDQM), то есть фактически в Европейской фармакопее. Это означает, что, если ГСО предназначен только для установления подлинности, применение его для количественного определения недопустимо. Если центр контроля качества лекарственных средств такую замену все же произведет, то в случае возникновения спора заключение о качестве соответствующего лекарственного препарата может быть признано недействительным.
Разработка и утверждение ГСО
Производство, оценка качества, фасовка и распределение ГСО - комплекс мероприятий, связанных с существенными финансовыми затратами. Поэтому важно определить, существует ли реальная потребность в конкретном стандартном образце. Применение ГСО обусловлено включением соответствующих указаний в ФС на лекарственное средство. Поэтому, в первую очередь, на стадии разработки ФС необходимо определить, можно ли использовать альтернативный метод анализа, не требующий применения стандартного образца и дающий такие же качественные результаты.
Если имеется реальная потребность в стандартном образце, разработчик лекарственного средства вместе с проектом ФСП на свою субстанцию или препарат составляет проект ФС на ГСО. Эта работа должна проводиться в соответствии с Общими рекомендациями по разработке, производству и распределению Государственных стандартных образцов, применяемых для контроля качества лекарственных средств и с учетом требований к соответствующему стандартному образцу ВОЗ.
Проект ФС на ГСО предоставляется в Фармакопейный государственный комитет одновременно с НД на соответствующее лекарственное средство, для контроля качества которого необходим ГСО. Фармакопейный комитет рассматривает эту документацию, вносит в проект ФС на ГСО необходимые поправки или отправляет его на доработку; возможен также отказ от применения соответствующего ГСО.
В дальнейшем проводится утверждение ФС на ГСО в установленном порядке и аттестация соответствующего стандартного образца. Организацию аттестации ГСО осуществляет Институт стандартизации лекарственных средств.
На последнем этапе президиум Фармакопейного государственного комитета утверждает соответствующий стандартный образец и вносит его в каталог ГСО.
Общие подходы к оценке качества ГСО
Субстанция, которую предполагается использовать в качестве ГСО, должна подвергаться всесторонней проверке, для чего необходимо использовать широкий спектр аналитических методов. Исследование качества исходного материала включает в себя следующее:
- оценка применимости субстанции для использования в качестве ГСО;
- определение значений физико-химических параметров, важных для дальнейшего использования ГСО.
Существует ошибочное мнение, что стандартный образец должен представлять собой вещество высокой степени чистоты. Однако в этом не всегда есть необходимость. Кроме того, стабильность субстанции может зависеть от степени очистки. Бывают ситуации, когда высокоочищенные вещества быстро разрушаются и теряют свойства, которые требуются при их использовании в определенных целях, в частности, в качестве стандартных образцов.
Итак, в общем случае чистота ГСО в пересчете на безводную и свободную от летучих растворителей субстанцию должна составлять не менее 99,5%.
В каждом отдельном случае требования к чистоте ГСО и объем проводимых исследований исходного материала зависят от области применения ГСО. Например, для установления подлинности лекарственного препарата (ИК- и УФ-спектрофотометрия, хроматография) достаточным качеством может обладать субстанция, произведенная в обычных условиях, и необходимость в высокой степени очистки (99,5% и более) может отсутствовать.
Обработка результатов количественных определений и анализов чистоты лекарственных средств, проведенных с использованием ГСО, осуществляется с учетом фактического содержания основного вещества в ГСО, которое рассчитывают как 100% минус содержание воды и летучих соединений. Если ГСО предназначен для использования в количественном анализе, основанном на хроматографическом методе, содержание примесей, определенное этим методом, также должно вычитаться из 100%. Если на этикетке отсутствует указание на процентное содержание или активность основного вещества, стандартный образец принимают за 100%.
Методы оценки качества ГСО
В Общих рекомендациях по разработке, производству и распределению Государственных стандартных образцов, применяемых для контроля качества лекарственных средств, разработанных на основе соответствующих рекомендаций ВОЗ, содержится исчерпывающая классификация методов оценки качества ГСО. В нее включены не только те методы, которые обычно применяются в фармакопейном анализе: ИК- и УФ-спектрофотометрия, хроматография, поляриметрия, определение воды методом Карла Фишера, титриметрия. Для оценки качества ГСО предлагаются различные, часто весьма дорогостоящие, методы анализа: ЯМР-спектроскопия, масс-спектрометрия, рентгеновская дифракционная кристаллография, элементный анализ, капиллярный электрофорез, дифференциальная сканирующая калориметрия, анализ фазовой растворимости. Из этого списка становится ясно, что стандартный образец должен быть всестороне охарактеризован, и что к его качеству предъявляются очень высокие требования. Это также указывает на то, что система ГСО устанавливает высокий уровень качества лекарственных веществ и готовых препаратов.
При фасовке ГСО необходимо соблюдать требования надлежащей производственной практики - Good Manufacturing Practice (GMP). Контейнеры для ГСО должны предохранять содержимое от проникновения влаги, света и кислорода. Наилучшими контейнерами для ГСО являются запаянные стеклянные ампулы, но и они имеют ряд недостатков: риск загрязнения субстанции частицами стекла при вскрытии ампул и сложность повторной укупорки ампул. Поэтому запаянные стеклянные ампулы используются в основном для веществ, которые должны быть изолированы от кислорода. Некоторые ГСО могут потребовать еще более жестких условий хранения.
Большинство ГСО может поставляться в более удобной упаковке - в контейнерах с возможностью повторного закрытия. Для облегчения поставки эти контейнеры должны быть одинакового типа и размера. Наиболее важным при оценке пригодности системы закрытия такого контейнера является определение ее устойчивости к проникновению влаги. В качестве таких контейнеров могут служить, например, стеклянные флаконы с плотно прилегающим резиновым колпачком и алюминиевой крышкой.
Фасовка ГСО в контейнеры является сложной и кропотливой операцией, требующей использования специального оборудования. Те вещества, которые имеют высокую стоимость или имеются в очень небольших количествах, могут распределяться по контейнерам в виде раствора, после чего растворитель удаляется путем лиофилизации или выпаривания.
Некоторые ГСО должна должны помещаться в контейнеры в токе инертного газа или в условиях контролируемой влажности. В этом случае необходимо использовать защитную камеру с перчатками или осуществлять все мероприятия в боксе.
Для большинства ГСО оптимальным является хранение в защищенном от света месте при температуре +5 град. С в контейнерах, предохраняющих образцы от проникновения влаги; следует избегать применения для этих целей помещений с повышенной влажностью.
Мониторинг стабильности ГСО
За рубежом мониторинг стабильности применяется с целью определения момента изъятия конкретной серии стандартного образца из употребления. То есть понятие "срок годности" обычно не применяется. Серия стандартного образца после изготовления делится на две неравные части: одна оставляется для осуществления мониторинга стабильности, вторая распространяется коммерчески. Как только определено, что значительные изменения в качестве стандартного образца исключают его дальнейшее применение, распространяется информация об изъятии неиспользованных упаковок со стандартом соответствующей серии.
В РФ было решено оставить прежнюю систему, и мониторинг стабильности согласно разработанным документам будет проводиться, так же, как и при производстве лекарственных средств, с целью определения срока годности. Использовать произведенный стандартный образец, соответственно, можно будет в пределах этого заранее установленного срока.
Безусловно, переход на новую систему ГСО потребует значительных усилий как со стороны Минздрава, так и со стороны фармацевтических производителей. Для этого необходимо не только время, но и взаимопонимание. И, конечно, создание идеальной системы в отдельной отрасли также невозможно. Речь, скорее, должна идти о поступательном развитии всего государства.
Если обратиться к истории, то можно заметить, что Декларация независимости США, в которой говорилось, в частности, о правах человека, была принята 4 июля 1776 года, а рабство удалось отменить только спустя 89 лет, причем в результате гражданской войны. Остается надеяться, что принятие современной системы ГСО не будет столь же длительным и болезненным.
академия им. И.М.Сеченова

Стандартные образцы – это дополнительно очищенные вещества, которые используются как эталонные при проведении анализа физическими, физико-химическими и биологическими методами. Стандартные образцы подразделяются на государственные стандартные образцы (ГСО), рабочие стандартные образцы (РСО) и стандартные образцы веществ-свидетелей (СОВС). ГСО выпускаются в соответствии со специальными требованиями. На них, как и на лекарственные вещества, имеются отдельные фармакопейные статьи. При расчете количественного содержания стандартный образец принимают за 100 %.
В качестве РСО используют образцы серийных лекарственных веществ, соответствующих требованиям фармакопейных статей на эти вещества.
Стандартные образцы веществ-свидетелей используют для определения примесей или компонентного состава лекарственных средств. В качестве СОВС могут быть использованы ГСО, РСО, а также вещества, специально изготовленные и аттестованные в порядке, предусмотренном частной фармакопейной статьей. Расчет количественного содержания индивидуального вещества в процентах (Х) в субстанциях проводят по формуле:
где D и D ГСО ? оптическая плотность растворов исследуемого и государственного стандартного образца соответственно;
С ? концентрация раствора стандартного образца, г/мл; а ? точная масса лекарственного вещества, г; 5, 100, 100 ? разведения, согласно НД, мл..
Более практичен вариант записи формулы (8), где указан способ приготовления раствора стандартного образца:
В фармацевтическом анализе достаточно часто используют значение удельного показателя поглощения определяемого вещества, например, при количественном анализе субстанций рутина, рибофлавина, феноксиметилпенициллина, капсул троксевазина, настойки пустырника, ингаляционного аэрозоля «Астмопент» и др.
3.3. По градуировочному графику
Готовят серию растворов (5-10) стандартного образца (ГСО или РСО) исследуемого вещества с постепенно возрастающей концентрацией. Измеряют оптическую плотность каждого из приготовленных растворов при ? max и строят график зависимости D = f (C) (рис. 7).
Затем измеряют оптическую плотность исследуемого раствора ? D х и графически определяют искомую концентрацию ? С х .
Рис. 7. Градуировочный график
Учитывая, что величина оптической плотности меняется в зависимости от используемой аппаратуры, градуировочный график строят для каждого конкретного прибора, на котором работает аналитик, и его периодически следует проверять. Содержание лекарственного вещества в процентах (Х) определяют по формуле:
C = С X ? P ( V ) ? 100 (15), m
где m ? масса (объем) лекарственного вещества или лекарственной формы, взятых для анализа, г (мл);

С х ? количество вещества, найденное по градуировочному графику, г/мл или %;
Р ? масса лекарственной формы, г; или V ? объем лекарственной формы, мл.
Данный способ используется редко для определения содержания лекарственных веществ. Однако градуировочный график позволяет определить диапазон концентраций анализируемого вещества, при котором соблюдается линейная зависимость оптической плотности от концентрации (подчинение основному закону светопоглощения Бугера- Ламберта-Бера) и является необходимым при разработке методик определения количественного содержания лекарственных веществ. Данные градуировочных графиков также используются для определения значений удельных показателей поглощения анализируемых веществ.
При этом для каждой концентрации рассчитывают значение
где n ? число фотометрируемых растворов.
3.4. Определение количества действующего вещества, перешедшее в раствор через время, указанное в НД при растворении таблеток (тест «Растворение»). См. Приложение 2 (таблетки анаприлина
0,01 г и 0,04 г, ФС 42-1549-98).
3.5. При испытаниях на однородность дозирования определяют содержание действующего вещества в каждой отдельной дозе,
см. Приложение 2 (таблетки анаприлина 0,01 г и 0,04 г, ФС 42- 1549-98).
В соответствии с современными требованиями для таблеток, стерильных сухих лекарственных средств для инъекций и лекарственных веществ в капсулах с содержанием вещества 0,05 г и менее обязательным является испытание на однородность дозирования. Для такой оценки требуется применение высокочувствительного метода. Одним из таких методов является УФ-спектрофотометрия.
При количественном определении целесообразно использовать такие полосы поглощения, которые отвечают следующим условиям:
• данная полоса поглощения должна быть по возможности свободна от наложения полос других компонентов анализируемой системы;
• выбранная полоса должна обладать достаточно высоким
показателем поглощения для индивидуального соединения.
При анализе используют максимум, реже – минимум полосы поглощения. Не следует производить измерения на участках крутого спада или подъема кривой.
АНАЛИЗ ДВУХ-И МНОГОКОМПОНЕНТНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Спектрофотометрический метод широко применяется в анализе многокомпонентных систем, так как в ряде случаев позволяет провести количественное определение компонентов без их предварительного разделения.
Здесь возможно несколько вариантов без предварительного разделения компонентов в зависимости от характера светопоглощения каждого их них.
1. Анализ соединений с неперекрывающимися полосами поглощения, когда одно вещество имеет максимум светопоглощения, а другое не поглощает УФ-свет в данной области.
Например анализ лекарственной формы, состоящей из дибазола и папаверина гидрохлорида, в которой качественное определение второго компонента может быть определено по собственному поглощению в длинноволновой области при длине волны 324 нм.
Это наиболее оптимальный вариант, позволяющий без разделения определить концентрацию обоих компонентов, содержащихся в лекарственной форме. В этом случае каждый из компонентов анализируют
в соответствующем максимуме светопоглощения.
2. Анализ лекарственной смеси, каждый из двух компонентов которой имеет свой максимум светопоглощения, в которой второй компонент оптически прозрачен.
Такие смеси анализируют методом изолированной абсорбции. Лекарственное вещество, в максимуме светопоглощения которого другой компонент не поглощает, определяют как в однокомпонентной лекарственной форме.
3. Анализ соединений с частично перекрывающимися полосами поглощения.
Расчёт содержания второго компонента (Х 2 ), в максимуме светопоглощения которого поглощает также первое вещество, проводят по
где D 1 ? оптическая плотность раствора в максимуме поглощения первого компонента;
D 2 ? оптическая плотность раствора в максимуме поглощения второго компонента (сумма светопоглощений растворов обоих компонентов);
Е 1 и Е 2 ? удельный показатель поглощения первого и соответственно второго компонента в их максимумах поглощения;
Е 3 ? удельный показатель поглощения первого компонента
в максимуме поглощения второго компонента;
а ? навеска (или объём) лекарственной формы, взятой для анализа, г (мл);
b ? общая масса (или объём) прописанной лекарственной формы, г (мл);
4. Анализ соединений с полным наложением полос поглощения.
Это наиболее сложный вариант анализа, разрешаемый расчётным методом Фирордта с использованием числа длин волн, превышающего число компонентов. Метод приемлем, если при двух длинах волн наблюдается значительное различие в интенсивности поглощения обоих компонентов при каждой выбранной для анализа длине волны. Затем для определения каждого компонента устанавливают оптическую плотность анализируемого раствора смеси при обеих длинах волн. Точность определения зависит от того, насколько велико различие между светопоглощением компонентов смеси: она будет наибольшей, когда одна длина волны является максимумом для второго компонента, а при второй длине волны наблюдается обратное явление.
При выполнении анализа методом Фирордта концентрацию (С 1 и С 2 ) в двухкомпонентной смеси рассчитывают по формуле:
С 1 = ? 1 D 1 ? ? 1 D 1 ; С 2 = ? 2 D 2 ? ? 2 D 2 .
Предварительно вычисляют значения коэффициентов ? 1. ? 2. ? 1. ? 2 :
компонентов при ? 2 ;
D 1 и D 2 – оптические плотности смесей при длинах волн ? 1 и ? 2 соответственно.
На основе использования метода Фирордта разработаны способы анализа многих лекарственных форм, например, содержащих кислоты салициловую и бензойную, резорцин и новокаин, смесь папаверина с анестезином и новокаином, смеси сульфаниламидов и др.
Недостаток метода Фирордта заключается в том, что при анализе трёх- и более компонентных систем даже небольшие ошибки в
измерениях Е 1% и D приводят к значительному снижению точности

ОСОБЕННОСТИ АНАЛИЗА ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ВИДИМОЙ ОБЛАСТИ СПЕКТРА
В видимой области спектра электромагнитное излучение (360-780 нм) обычно поглощают окрашенные вещества: либо за счёт собственной окраски (например, рибофлавин), либо за счёт окрашенных продуктов реакции определяемых веществ с реагентами (функциональный анализ). Основная сложность при реализации методики заключается в том, что многие реакции протекают достаточно медленно (при комнатной температуре иногда часами). Увеличение температуры приводит не только к ускорению основной реакции, но и побочных. Состав продуктов порой до конца неизвестен.
Требования к реакциям, применяемым в фотометрии
1. Полученное окрашенное соединение должно быть устойчивым и иметь постоянный состав.
2. Реакция должна протекать быстро.
3. Реакция должна быть стехиометрической.
4. Реакция должна быть избирательной и чувствительной.
5. Используемые реагенты должны быть доступны, экологически безвредны и рентабельны.
6. Продукт реакции должен иметь возможно большую величину удельного
коэффициента поглощения ( Е 1% ).
Для получения окрашенных соединений используют ряд реакций.
1) Получение АЦИ-солей с натрия гидроксидом на препараты, содержащие нитрогруппу (фурацилин, фуразолидон, левомицетин, нитроксолин и др.):
— EP (Европейская фармакопея) — BP (Британская фармакопея) — USP (Американская фармакопея) — WHO (Всемирная организация здравоохранения) — MicroMol — LGC Standards — Chroma Dex (фитостандарты) — PhytoLab — PhytoPlan Аналитические стандарты Для химии, нефтехимии, экологии, санитарного контроля производства. По каталогам: — Supelco — Fluka — Dr. Ehrenstorfer — AccuStandard — VHG — Ultra Scientific и других производителей. Многие отрасли химии и химического анализа предусматривают установление химического состава как количественного, так и качественного. В методах исследования, таких как хроматография, спектроскопия, флюорометрия — используются «стандарты» (стандартные образцы) в качестве образцов сравнения. Многие сложные приборы для физико-химического анализа предусматривают необходимость «стандартов» для точной настройки (калибровка прибора). Проверка точности приборов разного уровня сложности требуют «стандартов» для процедуры поверки. Стандартные образцы являются необходимым элементом в такой точной науке как химия. Под «стандартом» во всех этих случаях подразумевается заведомо известное химическое вещество достаточной высокой чистоты и определенной концентрации, или массы. Компания «ГалаХим» предлагает весь спектр химических «стандартов»: от особо чистых в фармакологическоактивных веществ, используемых в исследовании и анализе фармакологических объектов, заканчивая полимерными материалами, используемыми для калибровки и поверки спектральных приборов. Все предлагаемые стандарты отвечают высочайшим требования фармакопей всех континентов и всех методик (ISO) ведущих стран мира.
Обратитесь к нашим консультантам за более подробной информацией. Телефон: (495) 984-42-44 E-Mail: galachem@galachem.ru
Новости© GalaChem Group. All Right Reserved.
К сожалению, многие жители нашего государства не могут похвастаться отменным здоровьем и являются частыми посетителями больниц, а вследствие и аптечных киосков. Чтобы в аптеки поступали качественные, высокоэффективные препараты, государственные органы должны осуществлять их контроль и анализ. Нынешние методы анализа подразумевают применение фармацевтических стандартных образцов (фармакопейных стандартов). К этим образцам относятся: USP RS, BP CRS, ЕР CRS и программа МСИ. Стандартные образцы нужны для оценки качества лекарственных средств. Посредством них устанавливается подлинность медикаментов, оценивается содержание разных неорганических и органических примесей, устанавливается количество действующего вещества. Говоря проще, эти фармацевтические стандартные образцы представляют собой точно охарактеризованные лекарственные вещества, подвергающиеся тем же испытаниям, что и исследуемый препарат. К примеру, совпадение спектров испытуемого и стандартного веществ говорит о подлинности исследуемого препарата. Стоит отметить, что фармакопее Великобритании насчитывается около пяти сотен стандартных образцов, в американском фармакопее представлено тысячу триста образцов. В России циркулирует сто семьдесят стандартных образцов российских производителей, правда, большинство из этих веществ производятся в недостаточном количестве. В целом, в мире используется более трех тысяч семисот стандартных образцов примесей и лекарственных веществ, поэтому для проведения анализа с применением биологических и физико-химических их не достаточно. К предоставленным данным можно относиться с разной точки зрения, но нужно учитывать, что разработка, а также производство стандартных фармакологических образцов выступает дорогостоящим, трудоемким процессом. Стандартные образцы купить можно купить на сайте lgc-standards.ru
04.02.2010 PACE 2010 - 6-я Международная конференция и специализированная выставка красок и специальных покрытий
15.05.2009 Нефть, газ. Нефтехимия-2009
17.12.2008 CHEMTECH + PHARMA 2009
04.12.2008 Нефть. Газ. Химия. Экология - 2009
11.11.2008 НЕФТЕГАЗЭКСПО
27.09.2016 SHtukaturka v stroitelstve
27.09.2016 Pressnastil
27.09.2016 Raskleyka obyavleniy
21.09.2016 Populyarnost kitayskoy gruzovoy tehniki
21.09.2016 Vyvoz musora so stroyki
08.09.2016 Upravlenie gostinitsami
29.08.2016 Kak zastrahovatsya ot ubytkov pri sdache kvartiry v arendu
16.08.2016 Proektirovanie chastnyh domov
16.08.2016 Borodavki kak udalit
16.08.2016 Transfery SHveytsariya
10.12.2008 Иран прогнозирует увеличение производства полиэтилена в следующем году на 37%
08.12.2008 Dow Chemical сокращает 5 000 рабочих мест
08.12.2008 Европейская группа RPC закрывает завод расположенный в Италии.
01.10.2014 Россия и Иран договорились о реализации совместного нефтехимического проекта
01.10.2014 На РусВиниле глава РФ запустил изготовление поливинилхлорида
30.09.2014 ЛУКОЙЛ в Украине продаст АЗС за 3 сотни миллионов долларов
30.09.2014 Чудесный состав от томских химиков на Ямале поможет в выращивании новых видов деревьев
30.09.2014 В рамкха десятого Московского химического саммита будут представлены программы по развитию в РФ
26.10.2012 Палладий мономерного аквокомплекса.
01.11.2011 Запущен новый завод по производству упаковки, которая модифицирована нанокомпозитами
25.10.2011 Президия " Сколково" октроет R&D-центр
11.12.2008 Ожидается снижение дохода основных нефтехимических компаний Ближнего Востока
10.12.2008 Пожар на новом нефтеперерабатывающем заводе Reliance Petroleum's не ограничил работу
Заказы на стандартные образцы оформляются на основании предварительных заявок, представленных в письменном виде, например бумажное или электронное письмо, факс и т.д.
Срок исполнения заказов - от одного месяца.
Для оформления заказа используют номер каталога (подкаталога) и код товара.
Пример 1 - необходимо заказать образец песчаной почвы со следовым содержанием тяжелых металлов:
Пример 2 – необходимо заказать агар, используемый в американской фармацевтике:
Gaziz Ученик (88), закрыт 4 года назад
Лёка Высший разум (136597) 4 года назад
Не совсем так. Не "стандартные образцы проб", а просто - СТАНДАРТНЫЕ ОБРАЗЦЫ - вещества (материалы) с достаточно точно известными и официально аттестованными значениями величин, характеризующих их хим. состав, свойства, либо некоторые физико-химические или технологические параметры.
Например, я провожу анализ сплавов на содержание различных металлов на атомно-абсорбционном спектрофотометре. Для каждого из анализируемых металлов у меня есть стандартные образцы растворов с известной (заданной при изготовлении) концентрацией этих металлов. Выглядят у меня они так: 


Но это совсем необязательно. Могут быть и такие:  Всё зависит от того, какие параметры предполагается проверять при помощи этих СО. Все СО проходят сертификацию в Государственной службе стандартных образцов и вносятся в Государственный реестр стандартных образцов. В сертификате стандартного образца обязательно указывается срок его годности.
Всё зависит от того, какие параметры предполагается проверять при помощи этих СО. Все СО проходят сертификацию в Государственной службе стандартных образцов и вносятся в Государственный реестр стандартных образцов. В сертификате стандартного образца обязательно указывается срок его годности.
Злата Каурова Ученик (187) 8 месяцев назад
Только тогда уже по ГОСТу они называются - Государственный стандартный образец или ГСО-Эталонный стандарт, первичный (reference standard, primary): вещество, признанное подлинным материалом высокой степени чистоты по результатам обширных аналитических испытаний. Этот стандарт может быть:
1) получен из официально признанного источника;
2) приготовлен путем независимого синтеза;
3) получен из имеющегося промышленного материала высокой степени чистоты или
4) приготовлен путем дальнейшей очистки существующего промышленного материала.
Источник: ГОСТ Р 52249-2009
В фармакопеи Государственный стандартный образец (ГСО) - это стандартный образец, параметры качества которого регламентируются фармакопейной статьей, утвержденной в установленном порядке. В анализе готовых лекарственных форм могут использоваться рабочие стандартные образцы (РСО) лекарственных веществ (субстанций). РСО - это образец серийной субстанции, отвечающий требованиям соответствующего стандарта качества лекарственных средств.
Источник: ГОСТ 91500.05.001-00
В системе единства измерений Государственные Стандартные Образцы (ГСО) предназначены для:
Поверки, калибровки, градуировки средств измерений (СИ), а так же контроля метрологических характеристик при проведении испытаний, в том числе с целью утверждения типа;
Метрологической аттестации методик выполнения измерения (МВИ);
Контроля погрешностей МВИ в процессе их применения в соответствии с установленными в них алгоритмами, а так же для других видов метрологического контроля.
Порядок использования ГСО излагается в инструкциях по их применению. В комплект поставки каждого стандартного образца входит обязательный паспорт (или свидетельство) с указанием его метрологических характеристик и, как правило, инструкция по его применению.